A hibridização do carbono do tipo sp acontece somente quando ele realiza duas ligações pi (π) e duas ligações sigma (σ). Há, nesse caso, então, duas possibilidades: o carbono pode fazer duas ligações duplas ou uma ligação simples e uma tripla, conforme se observa a seguir:
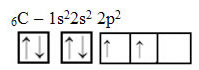
O texto “Hibridização do tipo sp3” mostra detalhadamente como ocorre a hibridização do carbono. Relembrando: a hibridização é a “mistura” de orbitais atômicos puros, que originam orbitais atômicos híbridos equivalentes entre si, porém diferentes dos orbitais puros originais. Assim, isso ocorre nos orbitais do carbono que originalmente eram representados assim:
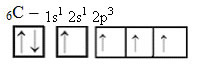
Porém, com o recebimento de energia, um elétron (representado por uma seta) do orbital 2s é promovido para o orbital 2p:
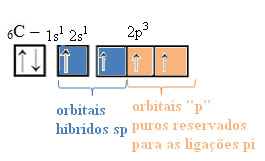
Dessa forma, o carbono fica com quatro orbitais desemparelhados, podendo realizar quatro ligações covalentes, não apenas duas.
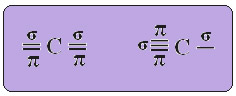
No caso da hibridização do tipo sp, sabemos que duas ligações serão pi; essas ocorrem nos orbitais “p” puros, enquanto que os outros dois orbitais, que são híbridos do tipo sp, realizarão as ligações sigma restantes.
A representação espacial dessa hibridização entre um orbital s e um p, originando um orbital híbrido sp, pode ser representada da seguinte forma:
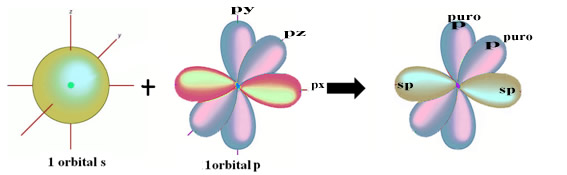
Na figura acima fica bem claro que há dois orbitais puros que realizarão as ligações pi.
Para você entender como isso ocorre, vamos pegar como exemplo uma molécula do gás cianídrico (HCN), usado nos Estados Unidos em câmaras de gás para detentos condenados à pena de morte. Sua fórmula estrutural é dada por:
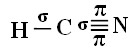
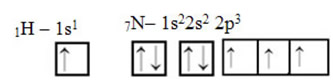
Quanto ao carbono, já foram mostrados os seus orbitais atômicos, agora veja os orbitais do hidrogênio e do nitrogênio:
Observe que o orbital desemparelhado do hidrogênio, que realizará a ligação sigma, é o “s”, que é representado espacialmente por um círculo; e os orbitais do nitrogênio são do tipo “p”, representados por três duplos ovoides (cada um em um campo espacial: x, y, z). Assim, a estrutura da molécula de HCN é representada da seguinte maneira:
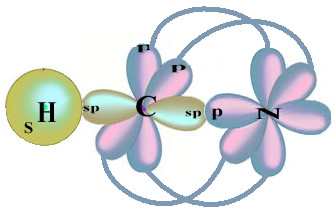
Quanto ao tipo de ligações existentes nessa estrutura do formol, temos:
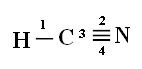
Ligações: 1 = σs-sp
2 = σp-sp
3 = 4 = πp-p
Por Jennifer Fogaça
Graduada em Química



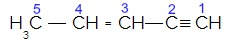
.jpg)