Propriedades periódicas
Propriedades periódicas apresentam periodicidade na tabela, ou seja, apresentam o mesmo comportamento a cada grupo ou período.
As propriedades periódicas são propriedades atômicas que apresentam periodicidade dentro da organização da Tabela Periódica. Isso quer dizer que apresentam o mesmo comportamento em todos os períodos e grupos dela, não sendo necessária uma avaliação completa da tabela para conhecê-las.
Essas propriedades estão relacionadas à carga nuclear efeitva dos elementos químicos, a qual aumenta conforme o número de elétrons de valência aumenta também. As principais propriedades periódicas são o raio atômico, a energia de ionização, a afinidade eletrônica e a eletronegatividade.
Leia também: Qual é a origem da Tabela Periódica?
Resumo sobre as propriedades periódicas
-
São propriedades atômicas que apresentam periodicidade dentro da Tabela Periódica.
-
Uma propriedade periódica apresenta o mesmo comportamento em todos os grupos e períodos da tabela.
-
As propriedades periódicas estão relacionadas à carga nuclear efetiva, que é a atração líquida causada pelo núcleo à eletrosfera.
-
As principais propriedades periódicas são raio atômico, energia de ionização, afinidade eletrônica e raio atômico.
O que são propriedades periódicas?
Os átomos possuem propriedades que têm relação específica com sua carga nuclear efetiva (Zef), que mensura a atração líquida do núcleo aos elétrons de valência. Os elétrons da camada de valência, embora atraídos pelo núcleo atômico, sofrem repulsão por parte dos elétrons mais internos, diminuindo a atração que o núcleo atômico exerce sobre eles, em um efeito conhecido como blindagem.
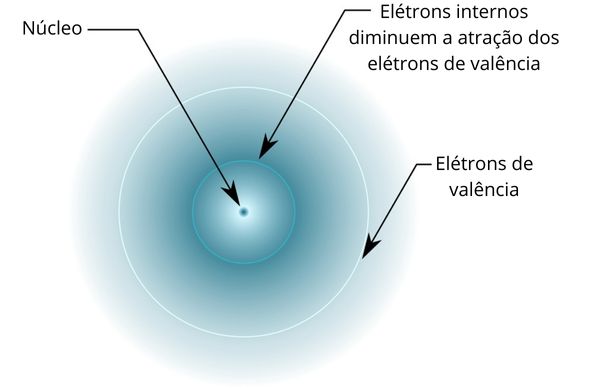
Dentro da Tabela Periódica, por conta da sua organização em ordem crescente de números atômicos, os elementos com o mesmo número de elétrons de valência são colocados em um mesmo grupo. A Zef aumenta conforme o número de elétrons de valência aumenta, mas a cada novo período da Tabela Periódica, os elétrons de valência retornam ao mínimo (um único elétron, grupo ns1). Com isso, como é possível perceber no gráfico a seguir, a variação da Zef apresenta um padrão de repetição, ou seja, periodicidade.
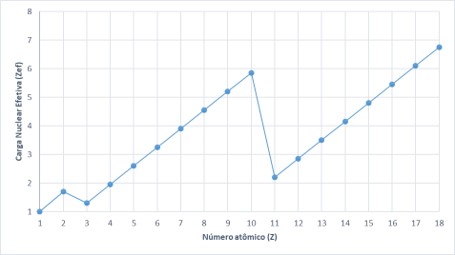
As propriedades atômicas que estudaremos a seguir estão relacionadas à carga nuclear efetiva, variando de forma diretamente ou inversamente proporcional com esta. Uma vez que a carga nuclear efetiva apresenta comportamento periódico, as propriedades atômicas, portanto, também apresentarão. Por isso, podem ser conhecidas como propriedades periódicas.
Quais são as propriedades periódicas?
-
Raio atômico: é igual à metade da distância entre dois núcleos de átomos vizinhos.
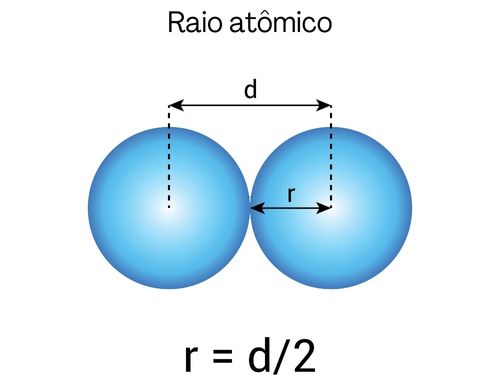
Seu comportamento é inversamente proporcional à Zef: cresce da direta para a esquerda na tabela, assim como de cima para baixo. Observe, a seguir, a variação de raios atômicos de elementos representativos (blocos s e p).
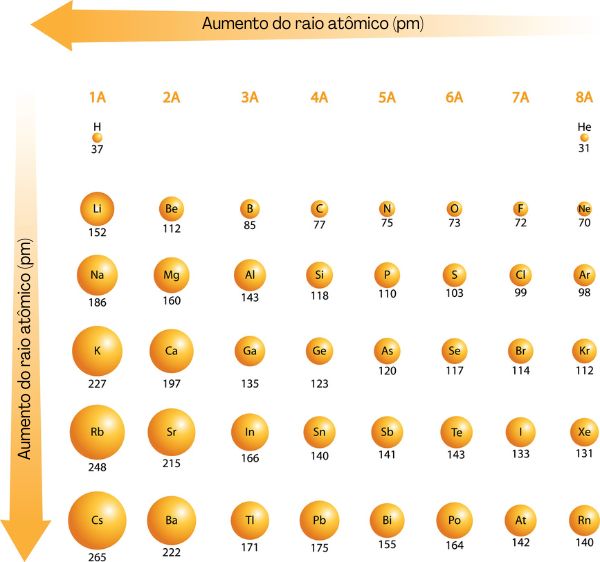
-
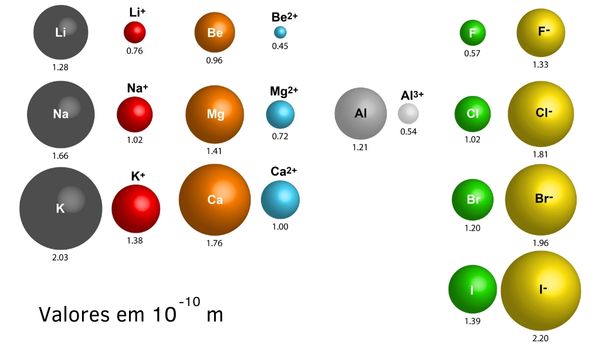
Raio iônico: o raio dos elementos na forma iônica é bem diferente da sua forma atômica. O raio iônico é a sua parte da distância entre íons vizinhos em um sólido iônico.
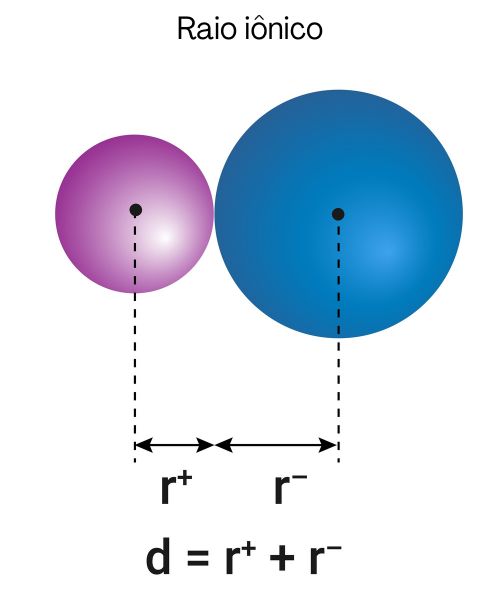
Na avaliação dos raios iônicos, o cátion sempre apresentará um raio menor do que seu átomo neutro, uma vez que a perda de elétrons acarreta um aumento da Zef, demonstrando que seus elétrons de valência serão atraídos com mais intensidade. Do contrário, o raio do ânion será maior que de seu átomo neutro, justamente por conta do decréscimo da Zef com a entrada de um novo elétron na estrutura, diminuindo assim a atração do núcleo à camada de valência.
-
Energia de ionização: é a mínima energia necessária para retirar um elétron de valência de um átomo isolado no estado gasoso. Possui relação direta com a Zef: quanto maior for a carga nuclear efetiva, mais energia é necessária para a retirada do elétron. Logo, maior a energia de ionização. Observe no gráfico a seguir.
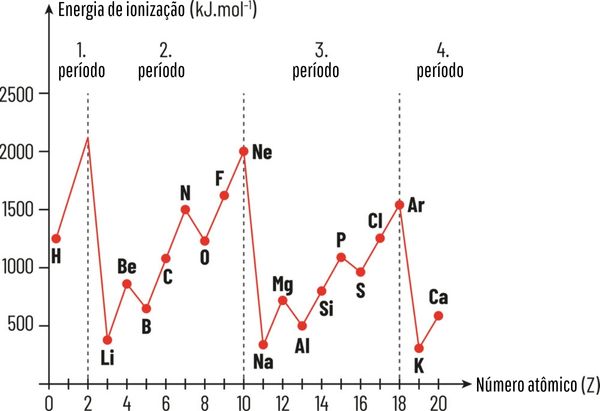
-
Afinidade eletrônica: também chamada de eletroafinidade, é a energia liberada ou absorvida quando um elétron se liga a um átomo na fase gasosa. Quanto mais negativo for o valor da afinidade eletrônica, maior a tendência do átomo a ganhar o elétron.
Podemos equacionar a afinidade eletrônica da seguinte forma:
X (g) + e- → X- (g) EAE(X) = E(X) – E(X-)
EAE(X) é a afinidade eletrônica do elemento X, sendo E(X) a energia do átomo X e E(X-) a energia do ânion X-, ambos em fase gasosa. Isso mostra que é possível os valores da afinidade eletrônica serem positivos ou negativos. Observe no gráfico a seguir os valores de eletroafinidade dos 20 primeiros elementos da Tabela Periódica.
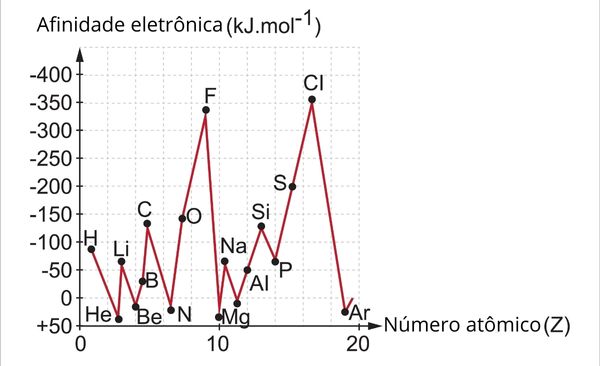
Quando a afinidade eletrônica é positiva, isso é um indicativo de que, na verdade, é necessário fornecer energia para que o átomo se ligue a um elétron. Espécies com esse comportamento são, em geral, os de baixa energia de ionização (como os metais alcalinos e alcalinoterrosos) e os gases nobres (cujo elétron adicional quebraria a sua condição de estabilidade). Do contrário, sendo negativa, há a indicação de que o processo de formação do ânion libera energia.
-
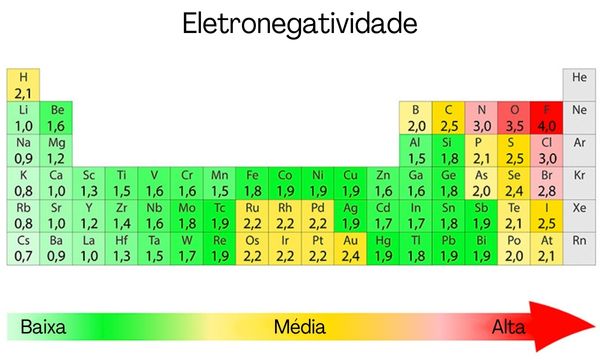
Eletronegatividade: foi um conceito introduzido por Linus Pauling, sendo a capacidade que um átomo tem de atrair elétrons para si. Robert Mulliken, prêmio Nobel de Química em 1966 pela sua explicação acerca das ligações covalentes, chegou a dizer que essa propriedade seria a média entre a energia de ionização e a afinidade eletrônica de um átomo. Contudo, uma escala desenvolvida por Pauling é mais frequentemente utilizada.
Diferenças entre propriedades periódicas e aperiódicas
Nem todas as propriedades dos átomos apresentam periodicidade, ou seja, não possuem relação com a carga nuclear efetiva. Nesse caso, são conhecidas como propriedades aperiódicas. São exemplos de propriedades aperiódicas a massa atômica e o calor específico.
-
Videoaula sobre propriedades periódicas e aperiódicas
Exercícios resolvidos sobre propriedades periódicas
Questão 1
(UFPR 2020) Em 2019, é comemorado o aniversário de 150 anos da primeira versão da Tabela Periódica, proposta por Dmitri Mendeleev. Ele criou um sistema que, além de catalogar os elementos, permitiu prever propriedades em função da posição que o elemento ocupa na tabela. Em 1869, o sódio (Na) e o potássio (K) já constavam da primeira versão da Tabela Periódica. Na versão atual, esses elementos pertencem ao primeiro grupo, o dos metais alcalinos. Esses metais reagem de maneira violenta com água, na qual se produz gás hidrogênio, conforme esquematizado abaixo:
2 M (s) + 2 H2O (l) → 2 MOH (aq) + H2 (g), M = Na ou K
A propriedade comum a esse grupo, que é responsável pelo comportamento descrito em água, é o:
A) alto valor de densidade.
B) baixo valor de energia de ionização.
C) baixo valor de volume atômico.
D) alto valor de eletronegatividade.
E) alto valor de afinidade eletrônica.
Resposta:
Letra B
Os metais já são reconhecidos pela baixa energia de ionização, e os metais alcalinos muito mais, afinal com apenas um elétron na camada de valência, a carga nuclear efetiva é muito baixa, facilitando a perda do elétron de valência. Isso explica sua reatividade, uma vez que perdem elétrons com certa facilidade.
Questão 2
(UERJ 2017) Recentemente, quatro novos elementos químicos foram incorporados à tabela de classificação periódica, sendo representados pelos símbolos Uut, Uup, Uus e Uuo. Dentre esses elementos, aquele que apresenta maior energia de ionização é:
A) Uut
B) Uup
C) Uus
D) Uuo
Resposta:
Letra D
No ano da questão, os elementos químicos 113 (nihônio), 115 (moscóvio), 117 (tenesso) e 118 (oganessônio) ainda não haviam sido oficializados pela Iupac. Dessa forma, ainda mantinham a sua alcunha em latim, sendo:
-
Uut: ununtrio, elemento 113, atual Nh.
-
Uup: ununpentio, elemento 115, atual Mc.
-
Uus: ununseptio, elemento 117, atual Ts.
-
Uuo: ununoctio, elemento 118, atual Og.
De qualquer forma, a energia de ionização cresce com o aumento da carga nuclear efetiva, ou seja, da esquerda para a direita. O elemento mais à direita é o elemento 118 e, por isso, é o de maior energia de ionização.
Por Stéfano Araújo Novais
Professor de Química
Fonte: Brasil Escola - https://brasilescola.uol.com.br/quimica/propriedades-periodicas.htm