Óxido nitroso
O óxido nitroso (N2O) é um gás incolor conhecido como gás hilariante. É usado como anestésico. Quando inalado, pode causar riso e um quadro semelhante à embriaguez.
O óxido nitroso é um gás incolor, não inflamável, de sabor adocicado e odor levemente prazeroso. Por causar efeitos de riso e sensação de embriaguez, é popularmente conhecido como gás hilariante. É um composto pouco reativo e com baixa solubilidade em água.
O óxido nitroso, N2O, é muito utilizado como analgésico e anestésico, algo que se iniciou ainda no século XIX. Embora seja reconhecido como um gás praticamente inerte, já se sabe que seu uso contínuo pode trazer malefícios. Além disso, é um conhecido gás de efeito estufa, contribuindo para o aquecimento global. Outro ponto de preocupação é que o óxido nitroso, quando na estratosfera, pode ser convertido a óxidos de nitrogênio, consumidores do gás ozônio.
Leia também: Monóxido de carbono — por que esse gás é tão perigoso para a nossa saúde?
Resumo sobre óxido nitroso
-
O óxido nitroso, N2O, é um óxido que também pode ser chamado de monóxido de dinitrogênio.
-
É um gás incolor, não inflamável, com sabor adocicado e odor levemente prazeroso.
-
Quando inalado, tal gás pode causar riso e uma sensação de embriaguez e, por isso, é conhecido como “gás hilariante”.
-
Apresenta geometria linear, é pouco reativo e pouco solúvel em água.
-
Sua principal aplicação é como analgésico e anestésico, o qual deve ser combinado com outras substâncias gasosas.
-
Sua concentração na atmosfera tem crescido bastante nos últimos anos, o que causa grande preocupação, pois é um gás de efeito estufa.
-
Além disso, na estratosfera, pode ser convertido a óxidos de nitrogênio, que podem consumir o ozônio.
O que é óxido nitroso?
O óxido nitroso é um composto de fórmula N2O, também chamado de monóxido de dinitrogênio e popularmente conhecido como gás hilariante.
Características do óxido nitroso
O óxido nitroso se apresenta como um gás incolor, não inflamável, com um leve odor prazeroso e de sabor adocicado. Quando inalado, pode causar riso, além de um quadro semelhante à embriaguez, o que acaba explicando seu apelido de “gás hilariante”.
É uma molécula de geometria linear, conforme mostrado a seguir em (A), embora os estudos acerca do comprimento da ligação indiquem que a estrutura de ressonância (B) apresenta certa contribuição.
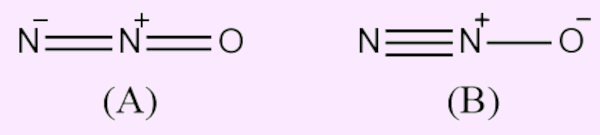
Em temperatura ambiente, é um composto muito pouco reativo, não sendo capaz de reagir com metais alcalinos, ozônio, cloro, bromo ou iodo. Alguns elementos que são bastante inflamáveis, como fósforo e carvão, até conseguem manter a combustão em atmosfera de óxido nitroso, assim como em atmosfera comum, porém é mais difícil de se iniciar a reação.
Veja também: Para que serve o gás hélio?
Propriedades do óxido nitroso
Algumas propriedades físicas do N2O estão listadas a seguir:
-
Massa molecular: 44,012 u
-
Ponto de fusão: –90,8 °C
-
Ponto de ebulição: –88,5 °C
-
Densidade: 1,799 g.L−1
-
Solúvel em etanol e éter etílico, pouco solúvel em água.
A dissolução de N2O em água origina uma solução neutra, mas com pouquíssima reação entre as espécies. Não à toa, o equilíbrio a seguir é significativamente deslocado para a esquerda.
N2O + H2O ⇌ H2N2O2
Aplicações do óxido nitroso
O óxido nitroso foi descoberto em 1772, pelo químico Joseph Priestley (um dos responsáveis pela descoberta do gás oxigênio), e, um pouco depois, em 1800, Humphry Davy descreveu sua ação analgésica. Ao fim do século XIX, suas propriedades anestésicas foram registradas em condições hiperbáricas por Paul Bert. Desde então, o N2O vem sendo usado como anestésico e analgésico, porém nunca sozinho.
Como anestésico, é usado na concentração de 50-70% em oxigênio, em conjunto com outras substâncias anestésicas voláteis, com a vantagem de reduzir a quantidade da substância volátil necessária e, assim, reduzindo a depressão cardiovascular causada pela maioria dessas substâncias. O mesmo ocorre na sua função analgésica, em que é comumente administrado junto de outras substâncias. Outro ponto favorável ao N2O é o seu baixo custo.
Alguns autores entendem que o N2O é um anestésico desatualizado, sem espaço na prática anestésica moderna. Contudo, ainda se entende que ele causa efeitos mínimos na respiração e na hemodinâmica, não havendo uma alternativa gasosa para tanto. Além disso, o óxido nitroso é usado como propelente/agente espumante em latas de chantili.

Obtenção e ocorrência do óxido nitroso
O óxido nitroso é comumente preparado pela decomposição do nitrato de amônio sólido em temperaturas que variam de 150-250 °C.
NH4NO3 → N2O + 2 H2O
A reação entre hidroxilamina (NH2OH) e ácido nitroso (HNO2) em meio aquoso permite a obtenção de um produto mais puro.
NH2OH + HNO2 → N2O + 2 H2O
Os níveis de óxido nitroso na atmosfera vêm aumentando cada vez mais, superando os 337 ppb (parte por bilhão, mg.ton−1) em janeiro de 2024. Para efeito de comparação, em 1800, os níveis eram próximos de 270 ppb.
Embora boa parte do óxido nitroso presente na atmosfera seja decorrente de atividade bacteriana nos solos e oceanos (cerca de 70%), a atividade humana é também significante na contribuição, muito por conta da agricultura, além da utilização de fertilizantes sintéticos e orgânicos, da produção de plantações fixadoras de nitrogênio e da utilização de estrume animal em terras agrícolas e pastagens.
O óxido nitroso também pode ser jogado na atmosfera em decorrência da utilização e queima de combustíveis fósseis.
Saiba mais: Quais são os gases do efeito estufa?
Riscos do óxido nitroso
Embora considerado uma substância segura e inerte, percebeu-se que a exposição continuada e crônica ao N2O pode causar a inativação da vitamina B12, pois a oxida, causando a inibição da enzima metionina sintase. Como sintoma da interação entre o N2O e a vitamina B12, há a depressão megaloblástica da medula óssea, assim como a neuropatia central e periférica.
Tais efeitos começaram ser descobertos durante as décadas de 1950 e 1960, quando pacientes em tratamento intensivo foram expostos a doses altas e continuadas de N2O. Como consequência, deixou-se de utilizar o óxido nitroso como anestésico em tratamento intensivo, bem como evita-se a inalação do gás por mais de seis horas contínuas.
Infelizmente, o N2O também é usado como droga (uso recreativo), apresentando picos de popularidade nos anos 1970 por conta de seus efeitos, que dão a sensação de que se está flutuando ou voando ao ser inalado em altas concentrações. Contudo, a utilização do óxido nitroso como droga causa hipóxia (baixo teor de oxigênio), além de congelamento das cordas vocais.
Impactos causados pelo óxido nitroso
O óxido nitroso é um gás de efeito estufa e, por isso, causa grande preocupação para o meio ambiente. Como dito, os seus níveis atmosféricos têm se elevado ano após ano. Apesar de seus níveis não serem tão elevados quanto os de CO2, principal gás estufa, entende-se que ele apresenta um potencial 296 vezes maior que o dióxido de carbono na questão do aquecimento global.

O óxido nitroso persiste por cerca de 120 anos na atmosfera antes de ser quimicamente decomposto. Outro impacto ambiental é que ele, na estratosfera, pode ser convertido a óxidos de nitrogênio, capazes de consumir o ozônio presente, assim, intensificando o buraco na camada de ozônio.
Créditos da imagem
Fontes
BANKS, A.; HARDMAN, J. G. Nitrous Oxide. Continuing Education in Anesthesia, Critical Care & Pain. v. 5, n. 5, 2005.
GAD, S. C. Nitrous Oxide. Encyclopedia of Toxicology. 3a. ed. p. 586-587. Cambridge, EUA: Academic Press, 2014.
GLOBAL MONITORING LABORATORY. Trends in N2O. Disponível em: < https://gml.noaa.gov/ccgg/trends_n2o/
HAMMERL, A.; KLAPÖTKE, T. M. Nitrogen: Inorganic Chemistry. In: Encyclopedia of Inorganic Chemistry. 2. ed. Wiley: Nova Jersey, 2005.
HAYNES, W. M. (ed.). CRC Handbook of Chemistry and Physics. 95a ed. CRC Press: 2014.
HOUSECROFT, C. E.; SHARPE, A. G. Inorganic Chemistry. 2. ed. Pearson Education Limited: Londres, 2005.
KNUF, K.; MAANI, C. V. Nitrous Oxide. StatPearls. 28 ago. 2023. Disponível em: https://www.ncbi.nlm.nih.gov/books/NBK532922/
WEIMANN, J. Toxicity of nitrous oxide. Best Practice & Research Clinical Anaesthesiology. v. 17, n. 1 p. 47-61, 2003.
WUEBBLES, D. J. Nitrous Oxide: No Laughing Matter. Science. vol. 326, n. 56, out. 2009.
Fonte: Brasil Escola - https://brasilescola.uol.com.br/quimica/oxido-nitroso.htm