Aminas
Aminas são compostos orgânicos derivados da amônia, nos quais um ou mais átomos de hidrogênio são substituídos por grupos alquila ou arila.
As aminas são um grupo funcional caracterizado pela presença de um átomo de nitrogênio ligado a um ou mais grupos alquila ou arila (anel aromático). Derivadas da amônia (NH3), elas desempenham papéis cruciais tanto em sistemas biológicos quanto em diversas aplicações industriais. No cotidiano, elas podem ser encontradas em produtos comuns, como medicamentos e cosméticos, nos quais atuam como ingredientes ativos ou estabilizantes.
Por exemplo, a anilina, uma amina aromática, é amplamente utilizada na produção de corantes para tecidos; enquanto a dimetilamina é um componente importante na fabricação de produtos de limpeza. Além disso, algumas delas funcionam como neurotransmissores, como a serotonina e a dopamina, regulando processos vitais no cérebro, como o humor e a memória.
Já na agricultura, elas são empregadas na síntese de pesticidas e fertilizantes, contribuindo para a eficiência das práticas agrícolas. Dessa forma, as aminas destacam-se não apenas por sua versatilidade química como também por sua ampla aplicação em áreas que impactam diretamente o dia a dia e o desenvolvimento tecnológico.
Leia também: O que são amidas?
Resumo sobre aminas
- Aminas são compostos orgânicos derivados da amônia que se caracterizam pela presença do grupo amino (-NH2).
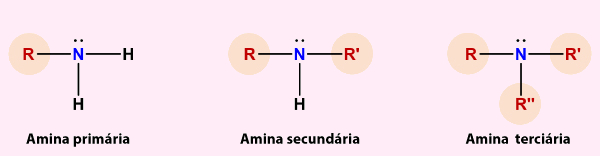
- Podem ser classificadas em primárias (um grupo orgânico ligado ao nitrogênio), secundárias (dois grupos orgânicos ligados ao nitrogênio), e terciárias (três grupos orgânicos ligados ao nitrogênio).
- Apresentam caráter básico devido ao par de elétrons não ligantes no átomo de nitrogênio.
- São encontradas em diversos processos biológicos, como na composição de neurotransmissores (dopamina, serotonina) e aminoácidos.
- Algumas aminas, como a trimetilamina, são responsáveis por odores característicos, como o cheiro de peixe em decomposição.
- São utilizadas na indústria química para a produção de fármacos, corantes e outros produtos químicos.
- As aminas alifáticas são solúveis em água em pequenas cadeias, enquanto as aromáticas têm menor solubilidade.
- Poliaminas, com dois ou mais grupos amino, desempenham papéis importantes no crescimento celular e no metabolismo.
- As aminas são essenciais na fabricação de produtos químicos e farmacêuticos, e melhoram a eficiência na produção agrícola.
Videoaula sobre aminas
O que são aminas?
As aminas compreendem uma classe de compostos orgânicos derivados da amônia (NH3), em que um ou mais átomos de hidrogênio são substituídos por grupos alquila ou arila, conforme os exemplos abaixo:
Exemplo 1:
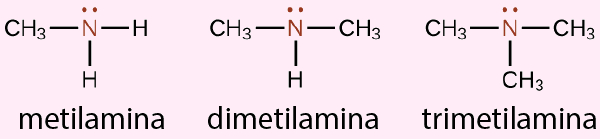
Exemplo 2:
Qual a fórmula das aminas?
A fórmula geral das aminas é representada pela escrita do seu grupo funcional amino -NH2, com o indicativo de substituição por um grupo alquila ou arila, sinalizado por R.
Dessa forma, tem-se:
R-NH2
Observação: Caso queira representar mais de uma substituição no nitrogênio, terá: R2NH e R3N.
Principais características das aminas
- Aminas são básicas devido ao par de elétrons não compartilhados no átomo de nitrogênio, o que lhes permite aceitar prótons (H+) de acordo com a teoria de Brönsted-Lowry.
- A maioria das aminas é polar, especialmente as primárias e secundárias, devido à diferença de eletronegatividade entre o nitrogênio e o hidrogênio ou os grupos alquila/arila.
- Aminas de baixa massa molar são solúveis em água devido à capacidade de formar ligações de hidrogênio com moléculas de água.
- Muitas têm odores fortes e característicos que podem variar de cheiro de peixe (metilamina) a odores mais complexos em aminas maiores.
- São reativas e participam de várias reações químicas, como alquilação, oscilação e formação de sais.
Veja também: Cetonas — compostos orgânicos que apresentam um grupo carbonila
Qual a função das aminas?
- Muitas aminas atuam como neurotransmissores no sistema nervoso, como a dopamina, serotonina e adrenalina, cruciais para a comunicação entre células nervosas.
- Algumas estão envolvidas na regulação de processos biológicos, como o metabolismo e a sinalização celular.
Classificação das aminas
No que tange à classificação das aminas, leva-se em consideração alguns critérios, como:
-
O número de substituições no átomo de nitrogênio
Segundo esse critério, as aminas podem ser primárias, secundárias e terciárias, conforme é ilustrado a seguir:
-
O tipo de radical ligado ao nitrogênio, se alquil ou arila
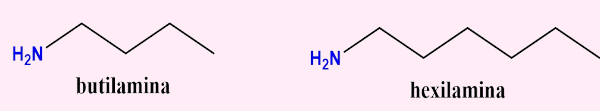
- Aminas alifáticas: grupo ou grupos ligados ao nitrogênio que são derivados de hidrocarbonetos de cadeias abertas ou não aromáticas (R-NH2). Exemplos: etilamina e dimetilamina:
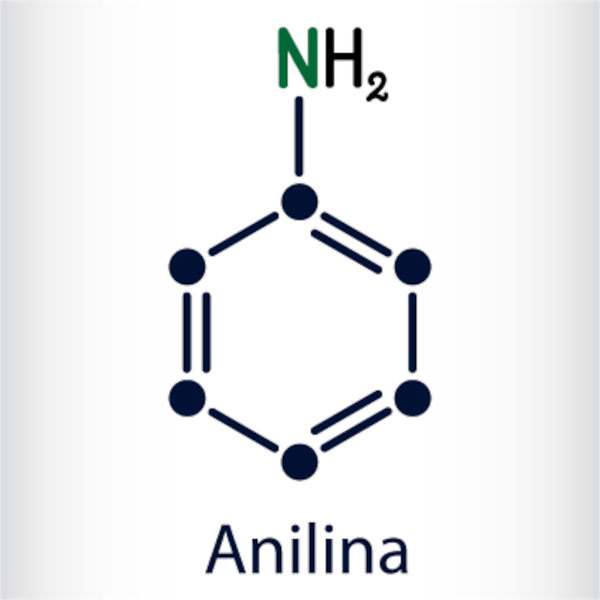
- Aminas aromáticas: nessas aminas, o nitrogênio está ligado a um anel aromático, como o benzeno (grupo arila). Costumam ser representadas com a seguinte notação: Ar-NH2. Exemplos clássicos são a anilina e a N-fenilbenzilamina:
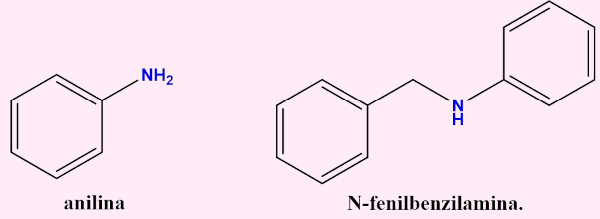
-
O número de átomos de nitrogênio presentes na molécula
Segundo esse critério, a amina pode ser uma monoamina, diamina, triamina, poliamina:
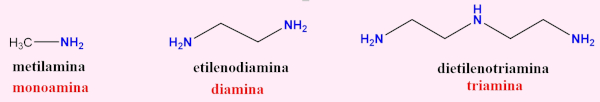
Além dessas classificações, existem aminas heterocíclicas, as quais têm o átomo de nitrogênio como parte de um anel heterocíclico. É o caso da pirrolidina e da piperidina:

Nomenclatura das aminas
Embora muitos nomes usuais (não sistemáticos) ainda sejam mantidos para vários compostos, a nomenclatura das aminas, assim como das demais funções orgânicas, segue as regras da União Internacional de Química Pura e Aplicada (Iupac). Nesse caso, veremos que há uma pequena diferença nas regras aplicadas para as aminas primárias em relação às secundárias e terciárias.
- Nomenclatura das aminas primárias: em regra, identifica-se a cadeia carbônica (enumerando-a a partir da extremidade mais próxima do grupo amino) e a localização das ramificações (quando houver) e do grupo funcional.
|
Exemplos:
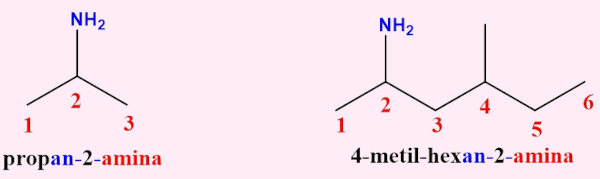
- Nomenclatura das aminas secundárias e terciárias: com diferentes grupos ligados ao nitrogênio, considera-se a cadeia mais longa como a principal e usa-se o prefixo N- para indicar os grupos substituintes (ramificações). Nesse caso, a regra principal é seguida, mas agora inclui-se N-prefixo + il, ficando da seguinte forma:
|
Exemplos:

- Nomenclatura das aminas aromáticas: quando a amina está ligada a um anel aromático, o nome base é benzenamina ou, como é usualmente conhecida, anilina, com os substituintes do anel indicados.
Exemplos:
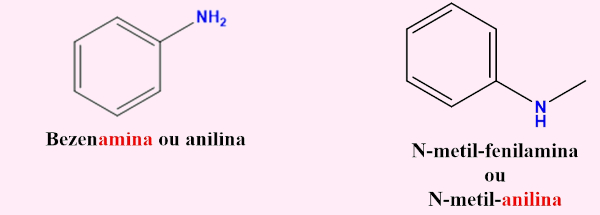
Aplicação das aminas
Por ser um grupo funcional amplo, isto é, com milhares de compostos, são inúmeras as aplicações das aminas. Sendo assim, podemos destacar algumas:
- Na indústria química: são usadas como precursores químicos, isto é, blocos de construção em síntese orgânica para a produção de corantes, fármacos, polímeros e outros compostos químicos.
- Na indústria farmacêutica: muitas drogas e fármacos, como antidepressivos e anestésicos locais, contêm aminas em sua estrutura.
- Como agentes tensoativos: são componentes em detergentes e sabões, ajudando a quebrar a tensão superficial dos líquidos.
- Como aditivos alimentares: certas aminas são usadas como conservantes ou intensificadores de sabor.
- Na agricultura: são utilizadas na formulação de pesticidas e fertilizantes.
- Como agente neutralizante: devido à sua basicidade, elas são utilizadas para neutralizar ácidos e catalisar reações em processos industriais e laboratoriais.
Qual a importância das aminas?
A importância das aminas pode ser percebida pelos inúmeros processos nos quais elas estão envolvidas, principalmente aqueles ligados à manutenção da vida, uma vez que elas podem ser encontradas em muitas moléculas essenciais nos organismos vivos. Um exemplo clássico é a histamina, uma amina biogênica que atua como mediador em respostas inflamatórias e alergias.
Outro exemplo importante são os aminoácidos, que contêm grupos amina e são os blocos de construção das proteínas, essenciais para todas as formas de vida. As proteínas, por sua vez, desempenham funções estruturais, enzimáticas e reguladoras nos organismos, demonstrando, portanto, a relevância das aminas em processos vitais.
Elas também têm papel central na transmissão de sinais no sistema nervoso. Desse modo, os neurotransmissores, como a dopamina, serotonina e adrenalina, são aminas que atuam no cérebro, modulando o humor, a resposta ao estresse e o comportamento.
Já no contexto ambiental, as aminas participam de processos bioquímicos que afetam a natureza e o meio ambiente, como a decomposição de matéria orgânica, que resulta na liberação de aminas, sobretudo em ambientes anaeróbicos, como os solos e sedimentos. Nesse sentido, aminas como a putrescina e a cadaverina são produzidas durante a degradação de proteínas, sendo indicadoras de decomposição.
Saiba mais: Qual a relação entre aminas e substâncias estimulantes?
Exercícios resolvidos sobre aminas
1. (UEMG) Em vários rótulos de temperos industrializados, é possível perceber-se a utilização do glutamato monossódico monoidratado. Essa substância é um aditivo utilizado como reforçador de sabor em alimentos e tem a seguinte fórmula estrutural:
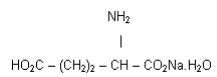
A análise dessa fórmula leva a concluir que esse aditivo
a) apresenta um grupo amino.
b) é insolúvel em água.
c) é um hidrocarboneto aromático.
d) possui uma molécula de gás carbônico.
Gabarito: A
A questão apresenta o grupo funcional amino, cuja identificação é possível pela combinação do -NH2 com um grupo alquil, caracterizando, portanto, uma amina.
2. (FAG-adaptada) Maresia é o cheiro do mar proveniente de odores carregados de aminas, que são exalados pelos animais marinhos. Acerca das aminas, é INCORRETO afirmar que:
a) a ureia [CO(NH2)2], principal fonte de excreção dos resíduos nitrogenados em peixes de água salgada, é um exemplo de amina secundária.
b) a substância responsável pelo cheiro de peixe podre é a trimetilamina, cuja solubilidade em água é maior do que a trietilamina.
c) após lidar com peixe, recomenda-se às pessoas lavarem as mãos com limão ou vinagre, que, por conterem ácidos, estes reagem com a amina, cujo caráter é básico.
d) as poliaminas são moléculas que apresentam dois ou mais átomos de nitrogênio.
Gabarito: A
Vamos analisar cada caso:
a) INCORRETO - A ureia não é uma amina. Ela é um composto orgânico que possui grupos amida (-CONH2), e não grupos amina.
b) CORRETO - A trimetilamina (CH3)3N é uma amina terciária.
c) CORRETO - Aminas, em geral, têm caráter básico. Quando em contato com ácidos (como os encontrados no limão ou vinagre), elas reagem formando sais, o que ajuda a neutralizar o cheiro desagradável.
d) CORRETO - Poliaminas são moléculas que possuem dois ou mais grupos amina (-NH2).
Créditos das imagens
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. As aminas, os amino-ácidos e as amidas. In: Princípios de Química: questionando a vida moderna e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018. p. 803–804.
FELTRE, R. Aminas. In: Química - V.3 - Química Orgânica. 6. ed. São Paulo: Editora Moderna, 2004. p. 108–109.
FELTRE, R.; YOSHINAGA, S. Aminas. In: Química Orgânica: Teoria e Exercícios. 1. ed. São Paulo: Editora Moderna LTDA, 1974. v. 4p. 406–410.
REIS, M. Aminas. In: Química 3. 1. ed. São Paulo: Editora Ática, 2013. v. 1p. 117–118.
Fonte: Brasil Escola - https://brasilescola.uol.com.br/quimica/aminas.htm