Benzeno
O benzeno é uma substância bastante tóxica e muito utilizada em laboratórios e processos industriais, servindo de matéria-prima para várias outras substâncias.
O benzeno é um composto orgânico classificado como um hidrocarboneto aromático. É bastante utilizado como matéria-prima nas indústrias, em processos laboratoriais, em companhias siderúrgicas e em indústrias petroquímicas para o refino do petróleo.
Leia também: Metano — o menor e mais simples dos hidrocarbonetos
Fórmula
O benzeno é um composto de fórmula molecular C6H6 e que possui uma estrutura extremamente estável. A fórmula estrutural do benzeno é representada da seguinte forma:
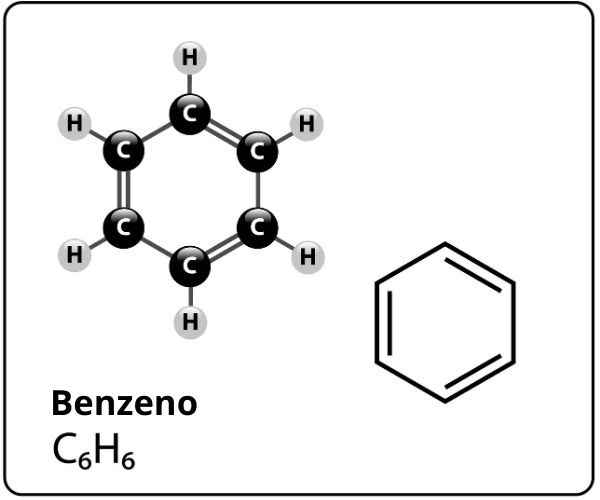
Quem propôs essa estrutura para o benzeno com seis átomos de carbono ligados entre si com duplas ligações alternadas, formando um hexágono e tendo ligado a cada um deles um átomo de hidrogênio, foi o químico alemão Friedrich August Kekulé, em 1866.
O benzeno sofre um fenômeno denominado ressonância, no qual os elétrons das ligações entre os carbonos diferem em sua posição. Por esse motivo, o benzeno pode ser representado da seguinte forma:
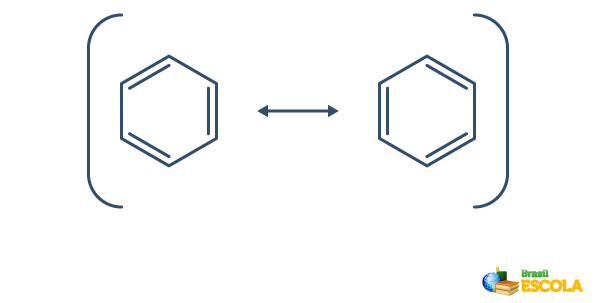
A estrutura real do benzeno é um intermediário entre as estruturas de ressonância mostradas acima. Isso não quer dizer que o benzeno ora se apresenta de uma forma, ora de outra, e nem que existem as duas formas ao mesmo tempo. Representamos o benzeno da seguinte forma:
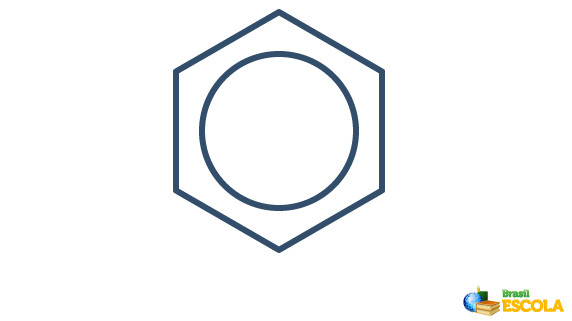
O círculo dentro do hexágono representa a ressonância existente entre os elétrons das ligações.
Características
- O benzeno é um líquido incolor, inflamável e com um aroma agradável característico.
- Fórmula molecular: C6H6.
- Massa molar: 78,11 g/mol.
- Densidade: 0,876 g/cm³.
- Temperatura de fusão: 5,5 ºC.
- Temperatura de ebulição: 80,1 ºC – sua baixa temperatura de ebulição explica a sua alta volatilidade (facilidade em evaporar).
O benzeno é uma substância tóxica e seus vapores podem causar tonturas, dores de cabeça e desmaios.
Leia também: Monóxido de carbono — gás incolor e inodoro extremamente tóxico
Aplicações e toxicidade do benzeno
O benzeno é utilizado principalmente como matéria-prima em indústrias para a produção de outras substâncias, como plásticos e polímeros à base de estireno, resinas, adesivos, nylon, borrachas, lubrificantes, pesticidas, etc.
O benzeno vem sendo substituído, principalmente em laboratórios, pelo tolueno, que apresenta polaridade e solubilidade semelhante às do benzeno, porém é menos tóxico e com maior temperatura de ebulição.
O benzeno está dentro do grupo das substâncias químicas consideradas cancerígenas, causando danos à medula óssea e leucemia, quando exposto a longo prazo em altas concentrações. A curto prazo, o benzeno pode causar tonturas, sonolência, aceleração do batimento cardíaco, convulsões e desmaios.
Por ser um líquido volátil, o benzeno libera gases com facilidade e, por isso, a contaminação por benzeno ocorre, principalmente, pelas vias respiratórias.
Onde o benzeno é encontrado?
A maior parte do benzeno liberado no meio ambiente resulta da ação humana, principalmente nas atividades industriais, mas também pode ser liberado como subproduto de queimadas e ainda de atividades vulcânicas.
O benzeno é uma das substâncias constituintes do petróleo e está presente na gasolina, sendo lançado na atmosfera pela queima dos combustíveis dos automóveis. Além disso, ele também é encontrado em refrigerantes e no cigarro.

Polaridade
O benzeno é uma molécula apolar, assim como todos os outros hidrocarbonetos e, por isso, apresenta baixíssima solubilidade em água (0.8 g/L a 15ºC). Em alguns procedimentos laboratoriais, o benzeno é utilizado como solvente orgânico de substâncias apolares.
Nomenclatura
Existe uma regra aplicada apenas para a nomenclatura dos compostos aromáticos, ou seja, que apresentam benzeno em sua estrutura. Essa regra é dividida em dois casos, que vão de acordo com a quantidade de radicais ligados ao anel benzênico.
1° CASO: quando há apenas um radical ligado ao anel benzênico, o nome é dado seguindo a regra a seguir:
NOME DO RADICAL + BENZENO
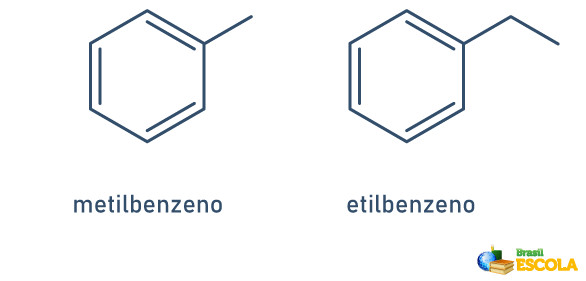
Note que não é necessária a indicação da posição do radical.
2° CASO: quando há mais de um radical ligado ao benzeno, o nome segue a seguinte regra:
POSIÇÃO DO RADICAL+ NOME DOS RADICAIS + BENZENO
Veja o exemplo:
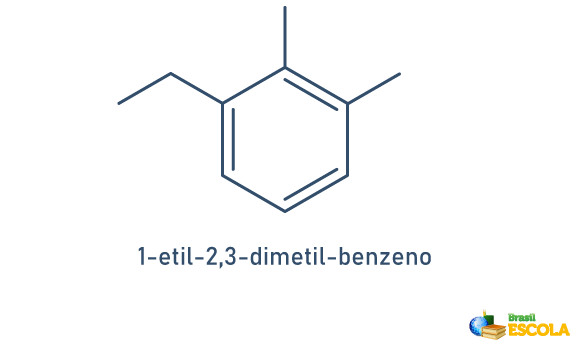
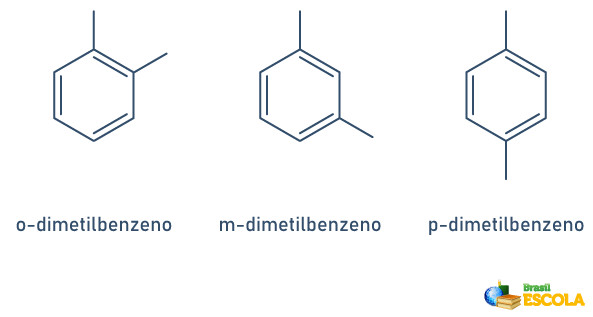
Quando o anel benzênico possui apenas dois radicais ligados, existe uma nomenclatura própria que pode ser utilizada:
- 1,2 ou orto (o);
- 1,3 ou meta(m);
- 1,4 ou para(p).
Veja os exemplos:
Leia também: Nitrato de amônio — composto altamente reativo usado na fabricação de explosivos
Curiosidades
- O benzeno é uma substância extremamente cancerígena, sendo classificado, pela Agência Internacional de Pesquisa sobre o Câncer, no Grupo 1, junto com tabaco, fumaça de óleo diesel e carnes processadas.
- Existem vários órgãos reguladores que limitam a exposição e a emissão de benzeno em diversos países. No Brasil, esse papel é de responsabilidade da Anvisa.
- Antes de conhecer seus riscos, o benzeno era utilizado em cosméticos, como loções pós-barba, por causa do seu cheiro agradável.
Por Victor Ricardo Ferreira
Professor de Química
Fonte: Brasil Escola - https://brasilescola.uol.com.br/quimica/benzeno.htm