Cloreto de sódio (sal de cozinha)
O cloreto de sódio (NaCl) é muito conhecido como sal de cozinha e é um importante composto iônico.
O cloreto de sódio é um composto químico de natureza iônica conhecido como sal de cozinha. É amplamente utilizado em diversos campos da sociedade, seja para produção de outros insumos químicos, seja na indústria alimentícia — já que é o tempero mais usado no mundo —, ou até mesmo no campo medicinal, para produção do soro fisiológico.
O cloreto de sódio é um sólido de elevado ponto de fusão, cristalino em sua forma pura, mas geralmente encontrado com uma coloração branca. É muito importante para o nosso corpo, uma vez que auxilia no equilíbrio de líquido do nosso organismo, entre outras funções importantes.
Leia também: Características químicas dos sais
Resumo sobre cloreto de sódio
- O cloreto de sódio, NaCl, é um sólido iônico conhecido como sal de cozinha.
- Apresenta diversos usos na indústria, seja para produzir outros insumos de grande importância, seja na indústria alimentícia, já que é um excelente conservante e o tempero mais usado no mundo.
- Na área medicinal, o seu uso também é elevado, uma vez que constitui o soro fisiológico.
- Na sua forma pura, o cloreto de sódio é um sólido cristalino incolor, mas, muitas vezes, é encontrado com coloração branca.
- Apresenta alto ponto de fusão e ebulição, além de excelente solubilidade em água e possibilidade de condutividade elétrica em sistemas aquosos ou fundidos.
- É produzido por mineração ou por evaporação de salmouras ou água do mar.
- É um importante agente para nosso corpo humano, principalmente na regulagem dos níveis de líquido de nosso organismo.
O que é o cloreto de sódio?
O cloreto de sódio, de fórmula química NaCl, é um composto químico, de natureza iônica, pertencente ao grupo dos sais e comumente conhecido como sal de cozinha.
Para que serve o cloreto de sódio?
Mais de 10 mil usos para o cloreto de sódio já foram identificados. Em geral, os principais usos são:
- Indústria química: dezenas de milhões de toneladas de cloreto de sódio são usadas anualmente para a indústria química, sendo que boa parte é empregada no processo cloro-álcali, que objetiva a produção de gás cloro e hidróxido de sódio via eletrólise aquosa do cloreto de sódio. Isso é uma grande vantagem, visto que o NaCl é barato e altamente distribuído, tornando o hidróxido de sódio a principal fonte de íons sódio para a indústria. Além disso, o sal é usado como matéria-prima de outros compostos, como clorato de sódio e sódio metálico. Na produção de sabão em pó e detergentes, o cloreto de sódio é utilizado para dar mais volume ao produto, além de atuar como coagulante para a dispersão coloidal após a saponificação. Com ácido sulfúrico, o cloreto de sódio é capaz de produzir sulfato de sódio e ácido clorídrico. O sódio metálico ainda é bastante utilizado na produção da azida de sódio, componente presente em airbags.

- Agente descongelante de rodovias e estabilizante de solo: o sal de cozinha é empregado em rodovias congeladas ou com presença de neve, pois o cloreto de sódio diminui a temperatura de fusão do gelo para cerca de -21 °C, impedindo que ele se solidifique, uma vez que nevascas ocorrem em temperaturas próximas a 0 °C. Isso é essencial para manter a mobilidade e a segurança das vias em regiões onde o inverno é mais rigoroso.
Também é usado para estabilizar o solo e prover firmeza às fundações em que rodovias serão construídas, pois o cloreto de sódio tem capacidade de minimizar os efeitos de deslocamento causados pela ação da umidade e intensidade de tráfego.

- Indústria alimentícia: o sal é o tempero mais consumido no mundo. Basicamente todos os animais têm um gosto inerente para o sal. Como é sabido, ao ser adicionado à comida, o sal incrementa o sabor da comida, tornando-a mais palatável. No Brasil, o consumo médio de sal de cozinha é de cerca de 9,34 g/dia, quase o dobro do recomendado pela Organização Mundial da Saúde, que é de 5 g/dia.
Além de tempero, o sal de cozinha atua como conservante alimentar (uma vez que cria um ambiente não propício para diversos microrganismos), ajuda no desenvolvimento da coloração de alimentos, além de poder controlar a textura e a fermentação.
O consumo de sal não é pensado só para seres humanos, mas para animais também. A suplementação de sal é importante para uma dieta balanceada, uma vez que o sódio é necessário para o metabolismo animal, além de ser necessário para a contração muscular. O íon sódio também está envolvido no transporte de materiais orgânicos pelas membranas celulares, assim como possui um papel importante na transmissão de impulsos nervosos e manutenção do ritmo cardíaco. Forragem com sal também pode ser usada para aumentar o apetite do animal, permitindo que os animais ganhem muito mais peso. A ausência de sal na dieta pode prejudicar o crescimento, aumentar os índices de mortalidade, causar sintomas nervosos, desidratação, além de queda de níveis de íons cloreto no sangue. Aditivos alimentares, como vitaminas e sais minerais, e medicamentos podem ser adicionados ao sal de consumo do animal.
Leia também: Funções inorgânicas — estudo sobre sais, óxidos, bases e ácidos
Fórmula do cloreto de sódio
O cloreto de sódio é um composto iônico, representado pela fórmula NaCl. Também é comum representar o composto destacando as cargas de seus respectivos íons: Na+Cl−. Na sua forma pura, contém 60,663% em massa de cloro e 39,337% em massa de sódio.
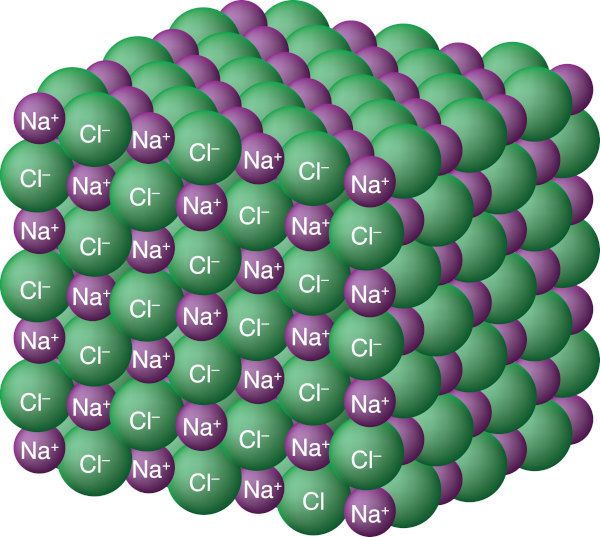
Características do cloreto de sódio
- Massa molar: 58,443 g.mol−1
- Aparência: incolor em sua forma pura. Na sua forma comercial, pode se apresentar como pequenos cristais com tamanhos diferentes, um pó de grânulos finos ou como blocos comprimidos. Ainda dentro do campo comercial, encontra-se majoritariamente na cor branca, podendo ser também cinza, vermelho ou, até mesmo, marrom. A alteração da coloração é consequência da presença de impurezas presentes.
- Ponto de fusão: 800,7 °C.
- Ponto de ebulição: 1465 °C.
- Solubilidade em água: 35,7 g/100 g (0 °C); 39,12 g/100 g (100 °C); 39,8 g/100 g (120 °C).
- Densidade: 2,17 g/cm³.
- Condutividade: capaz de conduzir corrente elétrica quando fundido ou quando dissolvido em água.

Obtenção do cloreto de sódio
O cloreto de sódio pode ser obtido de três formas:
- Mineração de solução seguida por evaporação mecânica: um depósito subterrâneo de sal pode ser obtido a partir da perfuração de poços de halita (sal de rocha, sal-gema ou sal fóssil, rico em cloreto de sódio). Para tal, injeta-se água pelos poços para se dissolver o sal lá presente, obtendo-se uma solução de salmoura, a qual é saturada de cloreto de sódio. A salmoura resultante pode ser levada para evaporação, produzindo-se sal granulado, ou até mesmo servir como produto intermediário para a obtenção de outros produtos químicos. A salmoura, antes de sofrer evaporação, pode também ser tratada quimicamente para fins de purificação, removendo níveis de impurezas, tais como cálcio, magnésio e sulfatos dissolvidos. Uma salmoura de maior nível de pureza é desejada para a produção de um cloreto de sódio de maior pureza, o qual é utilizado em células eletrolíticas para a produção de gás cloro e hidróxido de sódio.
- Mineração convencional: a halita é minerada de forma convencional, ou seja, seus depósitos são minerados por perfuração ou detonação. A perfuração é realizada com lâminas de carbeto de tungstênio, enquanto a detonação é feita com uma mistura de nitrato de amônio com óleo combustível. Com uma única detonação, pode-se extrair de 350 a 900 toneladas de halita. Depois que a área de detonação está devidamente liberada, ela é inspecionada para a obtenção de possíveis amostras de sal que possam ter ficado para trás.
- Produção com energia solar: o sal comercial também pode ser produzido pela evaporação natural de água do mar ou salmoura, em uma grande lagoa de terras com diques conhecidas como salinas. A evaporação ocorre por meio da radiação solar e ação do vento, produzindo uma salmoura concentrada com diversos sais minerais. Tais sais são separados, posteriormente, por cristalização fracionada. O carbonato de cálcio, como é o menos solúvel na salmoura, é o primeiro a ser cristalizado. Apesar de simples, o processo de produção de sal com energia solar requer grandes terrenos planos, em regiões de baixo índice pluviométrico, sol abundante e presença de correntes de vento para aquisição de bons rendimentos. Por isso, regiões próximas à costa marítima são ideais. A produção de sal por esse meio pode levar até dois anos, desde o momento que a água do mar é colocada na salina. Um sistema de produção de sal com energia solar pode produzir até 400.000 toneladas de sal por ano, se tiver uma área de 4000 hectares ou mais, a depender das condições climáticas.

Função do cloreto de sódio no corpo humano
Uma pessoa saudável, com cerca de 65 kg, contém cerca de 256 gramas de cloreto de sódio. A Organização Mundial da Saúde (OMS) sugere que a ingestão de cloreto de sódio seja de até 5 gramas por dia. Dessa quantidade, a maior parte (ou pelo menos metade) está no fluido extracelular do corpo.
O íon sódio atua com outros eletrólitos, principalmente o íon potássio, no fluido intracelular para regular a pressão osmótica e assim manter um equilíbrio de água adequado dentro do corpo. Também é importante na manutenção do equilíbrio ácido-base, na transmissão de impulsos nervosos e no processo de relaxação muscular.
É necessário, ainda, para a absorção de glicose e para o transporte de outros nutrientes pelas membranas celulares. Atua beneficamente no cérebro, acarretando em uma maior disposição e uma menor fadiga mental. Por conta de sua influência no cálcio, o sódio também pode auxiliar na dissolução de quaisquer pedras que possam ser formadas dentro do corpo. Por fim, o cloreto de sódio é importante na produção do ácido clorídrico no estômago e participa de diversas outras secreções glandulares.
Cloreto de sódio e o soro fisiológico
O soro fisiológico é uma solução que contém 0,9 % de cloreto de sódio em massa (9 mg/mL), pois assim alcança uma concentração muito próxima aos fluidos de nosso corpo, sendo que os íons sódio e cloro são os principais existentes no meio extracelular. Ele pode ser usado para reposição de eletrólitos e manter o equilíbrio adequado de água dentro do corpo, assim sendo indicado para episódios de desidratação em decorrência de vômito, diarreia, aspiração gástrica, sudorese excessiva, queimaduras, hemorragias e fístula digestiva.
O soro fisiológico também é empregado na limpeza dos olhos (desde que estéril), uma vez que tem uma composição muito próxima de nossas lágrimas, embora o excesso de sal possa causar irritação nos olhos. Também pode ser empregado na higienização de feridas e queimaduras, uma vez que é atóxico e não danifica os tecidos durante a cicatrização. O sal presente no soro força a saída de água das células e bactérias, mantendo a ferida limpa. Contudo, o soro fisiológico não é capaz de eliminar bactérias ou remoção de detritos.
No procedimento de nebulização, o soro fisiológico é muito indicado para o tratamento de sinusite, gripes ou resfriados, uma vez que ajuda na umidificação das vias aéreas. Outro uso comum do soro fisiológico na nebulização é para a diluição de medicamentos, como é o caso da budesonida ou o salbutamol.
Não só na nebulização que o soro fisiológico ajuda o veículo de medicamentos, mas também para medicação intravenosa. Nesse caso, soro fisiológico estéril é aplicado na diluição de medicamentos em pó para que estes sejam colocados no acesso intravenoso.
A limpeza com soro fisiológico também pode ser feita para o nariz, rosto e ouvidos. No caso do nariz, a aplicação de soro fisiológico auxilia no processo de desentupimento e eliminação de secreção, com o auxílio de uma seringa sem agulha ou uma garrafa, uma vez que a pressão exercida faz com que a água seja forçada a passar pelas narinas, assim realizando a lavagem nasal.
Exercícios resolvidos sobre cloreto de sódio
Questão 1
(Enem PPL/2021) Um produto, obtido industrialmente da eletrólise de solução aquosa de cloreto de sódio, tem sido amplamente empregado na indústria, por exemplo, na fabricação de papéis, tecidos e sabões. Normalmente, esse produto é usado na desobstrução de encanamentos e sumidouros, pois é capaz de reagir com gorduras. No entanto, a sua manipulação exige cuidados, pois é altamente corrosivo, podendo, em contato com a pele, provocar vermelhidão, irritação ou “queimaduras” de tecidos vivos. Além disso, se o frasco do produto for abandonado aberto por um longo período de tempo, ele pode absorver CO2 convertendo-se em um sal.
Esse produto industrial é o
(A) cloro molecular, Cl2.
(B) ácido clorídrico, HCI.
(C) ácido sulfúrico, H2SO4.
(D) hidróxido de sódio, NaOH.
(E) carbonato de sódio, Na2CO3.
Resposta: Letra D.
Segundo o processo cloro-álcali, a eletrólise aquosa do NaCl produz cloro gasoso e hidróxido de sódio, NaOH, um produto alcalino cujas características são as descritas no texto. Portanto, o produto industrial referido é o NaOH.
Questão 2
(Enem PPL/2020) Um cidadão que se mudou de Brasília para Recife, após algum tempo, percebeu que partes de seu carro estavam enferrujando muito rapidamente. Perguntou para seu filho, estudante do ensino médio, a explicação para o fenômeno. O filho pesquisou na internet e descobriu que, por causa da maresia, gotículas de água do mar atingem os objetos de aço (liga de ferro e carbono) e intensificam sua corrosão. Com base nessa informação, o estudante explicou corretamente ao pai o efeito do cloreto de sódio na corrosão.
A explicação correta de a maresia acelerar a corrosão do aço é porque
(A) reduz o ferro.
(B) oxida o carbono.
(C) dissolve a pintura do carro.
(D) torna a água mais condutora.
(E) diminui a dissolução do oxigênio na água.
Resposta: Letra D.
A presença de cloreto de sódio nas gotículas de água faz aumentar a condução elétrica, uma vez que ele se dissolve na água, formando uma solução eletrolítica:
NaCl (s) → Na+ (aq) + Cl− (aq)
Com um aumento da corrente, o processo corrosivo ocorre mais rapidamente.
Fontes
FELDMAN, S. R. Sodium Chloride. In: Kirk-Othmer Encyclopedia of Chemical Technology. Nova Jérsei, EUA: John Wiley & Sons, 2001.
WORLD HEALTH ORGANIZATION – WHO. Sodium reduction. World Health Organization. 7 fev. 2025. Disponível em: <https://www.who.int/news-room/fact-sheets/detail/sodium-reduction>. Acesso em 26 fev. 2025.
RAJASEKARAN, A. Nutraceuticals. In: Comprehensive Medicinal Chemistry III. p. 107-134. Amsterdã, Países Baixos: Elsevier, 2017.
COSTA, F. Soro fisiológico: o que é, para que serve e 8 formas de usar. Tua Saúde. dez. 2023. Disponível em: <https://www.tuasaude.com/soro-fisiologico/>. Acesso em 26 fev. 2025.
HAYNES, W. M. (ed.) CRC Handbook of Chemistry and Physics. 95a ed. CRC Press: 2014.
Fonte: Brasil Escola - https://brasilescola.uol.com.br/quimica/cloreto-sodio.htm