Número de Avogadro
O número de Avogadro permite quantificar o número de entidades elementares em um sistema.
O número de Avogadro é uma constante de proporcionalidade entre a quantidade de matéria (mol) e o número exato de entidades elementares presentes no sistema. Sua unidade, mol−1, deve ser lida como “por mol”.
Desde 2019, é uma das sete unidades definidoras do Sistema Internacional de Unidades (SI), correspondendo a 6,02214076 x 1023 mol−1. Serve para determinar a quantidade exata de entidades elementares, tais como átomos, íons e moléculas, em sistemas.
Leia também: O que é mol?
Resumo sobre o número de Avogrado
- O número de Avogadro (NA) é igual a 6,02214076 x 1023 mol−1.
- É também referido como constante de Avogadro e serve para medir a quantidade exata de entidades elementares presentes no sistema.
- É uma constante de proporcionalidade entre a quantidade de matéria (mol) e o número exato de entidades elementares que se encontram no sistema.
- É, desde 2019, uma das sete constantes definidoras do Sistema Internacional de Unidades (SI).
Qual é o número de Avogadro?
O número de Avogadro (NA) é igual a 6,02214076 x 1023 mol−1 entidades elementares, que podem ser átomos, íons, moléculas, entre outros.
O que é o número de Avogadro?
O número (ou constante) de Avogadro (NA) é, desde 2019, uma das sete unidades definidoras do Sistema Internacional de Unidades (SI). A sua unidade é mol-1 (lê-se “por mol”).
É uma constante de proporcionalidade entre a quantidade de matéria da substância (mol) e o número exato de partículas (átomos, íons, elétrons, moléculas…).
Para que serve o número de Avogadro?
Sendo uma das sete constantes definidoras do SI, o número de Avogadro se torna uma referência fundamental, estável e universal, assim possibilitando a obtenção das menores incertezas possíveis. Não só isso, qualquer unidade do SI pode ser expressa por meio de uma das constantes definidoras, ou por meio do produto ou quociente destas.
O NA é uma constante de proporcionalidade que permite mensurar a quantidade de matéria de um sistema, ou seja, o número específico de entidades elementares presentes, como um átomo, um íon, uma molécula, um elétron, ou qualquer outra partícula ou grupo específico de partículas.
Número de Avogadro e o mol
O mol (cujo símbolo também é “mol”) é a unidade de quantidade de matéria do SI. A quantidade de partículas elementares contidas em 1 mol de partículas elementares é igual ao número de Avogadro, ou seja, 6,02214076 x 1023.
Sendo uma constante de proporcionalidade, o NA pode ser utilizado para determinar o número exato de entidades elementares no sistema (N), por meio do cálculo:
N = NA x n
Em que “n” é o número de mols da entidade elementar observada. N é uma unidade adimensional (ou de unidade 1).
Leia também: Massa molar e número de mol
Número de Avogadro e a massa molar
A massa molar (MM) é entendida como a quantidade de massa de entidade elementar observada na quantidade de 1 mol de entidades elementares. Em termos mais simples, é a massa observada em 6,02214076 x 1023 entidades elementares. Sua unidade é, portanto, g∙mol-1 (lê-se “grama por mol”).
Dessa forma, pode-se definir a massa molar por meio do número de Avogadro:
MM = NA x m
Em que “m” é a massa de uma única entidade elementar.
Outra relação importante envolvendo massa molar e o número de Avogadro se dá por uma derivação da fórmula:
N = NA x n
Como a massa molar é dada em g∙mol−1, podemos entender que a massa molar é igual:
MM = m/n
Em que “n” é o quantidade de matéria, em mol, da entidade elementar, enquanto “m” é a massa de entidade elementar, em grama, presente. Assim, pode-se dizer que:
n = m/MM
E, assim sendo:
N = NA x (m/MM)
Com isso, encontramos a quantidade em matéria exata de entidade elementar tendo a sua massa e a sua massa molar com a ajuda do número de Avogadro.
Fórmula do número de Avogadro
Para se encontrar o número exato de entidades elementares, em mol, pode-se utilizar a expressão:
N = NA x n
Em que “N” é o número de entidades elementares observadas no sistema e “n” é a quantidade de matéria (em mol) destas entidades elementares.

Exercícios resolvidos sobre número de Avogrado
Questão 1. (Santa Casa – Conhecimentos Gerais/2025) A tabela apresenta a abundância isotópica do magnésio encontrado na natureza.
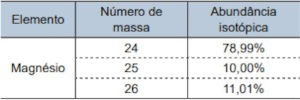
Considerando a constante de Avogadro igual a 6,0 × 1023 mol–1, em 4,86 g de magnésio, a quantidade de átomos de magnésio-25 é igual a
- 1,3 × 1021.
- 3,0 × 1020.
- 1,2 × 1022.
- 9,4 × 1022.
- 6,0 × 1023.
Resposta: Letra C.
Em 4,86 g de magnésio, apenas 10% correspondem ao magnésio-25, portanto a massa de magnésio-25 é igual a 0,486 g.
Sendo a massa molar do magnésio igual a 24,3 g/mol, podemos dizer que:
N = NA x n
N = NA x (m/MM)
N = 6,0 x 1023 x (0,486/24,3)
N = 6,0 x 1023 x 2,0 x 10−2
N = 12,0 x 1021
N = 1,2 x 1022
Questão 2. (USS-Univassouras-Medicina/2024.2) Admita que determinada peça metálica de alumínio empregada na imobilização de fraturas apresenta massa igual a 5,4 g.
O número de átomos de alumínio presentes nessa peça é igual a:
- 1,8 x 1023
- 1,2 x 1023
- 1,8 x 1022
- 1,2 x 1022
Resposta: Letra B.
Sabendo que a massa molar do alumínio é igual a 27 g/mol e a massa da amostra apresentada é de 5,4 g, podemos encontrar o número de átomos de alumínio (N), por meio da seguinte fórmula:
N = NA x (m/MM)
N = 6,0 x 1023 x (5,4/27)
N = 6,0 x 1023 x 2,0 x 10−1
N = 12,0 x 1022
N = 1,2 x 1023
Fontes:
INSTITUTO NACIONAL DE METROLOGIA, QUALIDADE E TECNOLOGIA (INMETRO); INSTITUTO PORTUGUÊS DE QUALIDADE (IPQ). Sistema Internacional de Unidades (SI). 2ª edição da tradução luso-brasileira. Brasília, DF: Inmetro, 2025.
Fonte: Brasil Escola - https://brasilescola.uol.com.br/fisica/a-lei-avogadro.htm