Temperatura e Velocidade das Reações
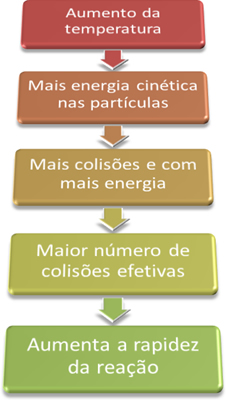
O aumento na temperatura aumenta a energia cinética das partículas dos reagentes, aumentando a quantidade de choques efetivos e a velocidade das reações.
Quanto maior for a temperatura, maior será a velocidade de uma reação.
Isso pode ser facilmente visto em diversas situações em nosso cotidiano, como nos exemplos a seguir:
- Quando queremos diminuir a velocidade da reação de decomposição de um alimento, nós abaixamos a temperatura, colocando-o na geladeira;

- Se quisermos aumentar a velocidade da reação de cozimento dos alimentos, basta colocá-los numa panela de pressão que, com o aumento da pressão, aumenta também a temperatura de ebulição da água líquida em que o alimento está;

- Os incêndios, em geral, costumam ser devastadores porque a temperatura do ambiente vai aumentando, o que provoca um aumento na velocidade da reação de combustão;
- Para diminuir a velocidade dos processos químicos metabólicos, diminuindo as chances de lesões nos cérebros por causa da deficiência de oxigênio, algumas cirurgias são realizadas diminuindo-se a temperatura do corpo do paciente, ficando em cerca de 15ºC;
- Se colocarmos um comprimido efervescente num copo com água quente e outro num copo com água fria, o primeiro irá dissolver-se bem mais rápido.
Mas, o que explica a influência diretamente proporcional da temperatura sobre a velocidade da reação?
Isso acontece porque, conforme explicado no texto “Condições para Ocorrência de Reações Químicas”, para que uma reação se processe é preciso satisfazer algumas condições, como a de que as partículas devem se chocar eficazmente e com a energia mínima necessária, que é denominada de energia de ativação.
Assim, quando aumentamos a temperatura do sistema, aumentamos também a agitação das partículas reagentes e fornecemos mais energia cinética para elas. Com isso, mais colisões ocorrerão e com mais energia, aumentando a quantidade de partículas que reagirão e, consequentemente, aumentando a velocidade da reação.
Por Jennifer Fogaça
Graduada em Química
Fonte: Brasil Escola - https://brasilescola.uol.com.br/quimica/temperatura-velocidade-das-reacoes.htm