Reação orgânica de hidrogenação
Na reação orgânica de hidrogenação, ocorre a quebra de insaturações e a adição de um ou mais átomos de hidrogênio à molécula de hidrocarbonetos.
A hidrogenação ocorre com hidrocarbonetos acíclicos insaturados, isto é, que possuem cadeias abertas com duplas ou triplas ligações, como os alcenos, alcinos e dienos. Ela pode ocorrer também em hidrocarbonetos aromáticos, pois eles possuem duplas ligações no anel, e com os ciclanos (cicloalcanos) de até cinco carbonos.
Esses compostos reagem como o gás hidrogênio na presença de algum catalisador, tais como o níquel, a platina e o paládio, sob aquecimento. Assim, ocorre uma reação de adição, em que a ligação pi (π) é quebrada, formando-se duas novas ligações simples e o hidrogênio é introduzido à molécula.
Genericamente, temos:
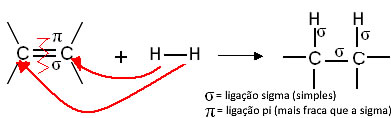
Reação genérica de hidrogenação
Agora vejamos alguns exemplos:
- Hidrogenação em alcenos: O produto obtido é um alcano.
Abaixo temos uma reação de hidrogenação do eteno (ou etileno) com a obtenção do etano:
.jpg)
Exemplo de reação de hidrogenação do eteno
Esse tipo de hidrogenação catalítica é usado pela indústria de alimentos para fabricar gorduras semissólidas, como as margarinas. Os óleos vegetais e as gorduras diferenciam-se somente pelo fato de que os óleos possuem longas moléculas com duplas ligações entre os carbonos, enquanto as gorduras possuem somente ligações simples entre seus carbonos.
Assim, para converter um óleo em uma gordura, basta realizar a hidrogenação do óleo. Dessa forma, suas ligações duplas serão quebradas e convertidas em ligações simples. O resultado é a produção das chamadas gorduras vegetais hidrogenadas.
- Hidrogenação de alcinos: Visto que os alcinos possuem duas ligações pi, a sua hidrogenação completa ocorre em duas etapas, sendo que na primeira forma-se um alceno e na segunda, um alcano.
Na reação abaixo, temos a hidrogenação do propino com formação final do propano:
1ª etapa: H3C ─ C ≡ CH + H2 → H3C ─ CH ═ CH2
2ª etapa: H3C ─ CH ═ CH2 + 2 H2 → H3C ─ CH2 ─ CH3
Se quisermos que essa reação pare na 1ª etapa, devemos usar alguma substância que interrompa a ação do catalisador.
- Hidrogenação de dienos: Existem três tipos de dienos: acumulados (as duplas ligações aparecem de forma seguida), isolados (as duplas ligações estão separadas por pelo menos duas ligações simples) e conjugados (as duplas ligações aparecem de forma alternada).
A hidrogenação dos dienos acumulados e isolados ocorre da mesma forma que vimos para os alcenos, porém, em dobro, pois os dienos possuem mais insaturações. Veja dois exemplos:
* Exemplo de hidrogenação em dieno acumulado:
H H H
│ │ │
H3C ─ CH ═ C ═ CH ─ CH3 + 2 H2 → H3C ─ CH ─ C ─ CH ─ CH3
│ │ │
H H H
* Exemplo de hidrogenação em dieno isolado:
H H H H
│ │ │ │
H3C ─ CH ═ CH ─ CH2 ─ CH ═ CH ─ CH3 +2 H2 → H3C ─ CH ─ CH ─ CH2 ─ CH ─ CH ─ CH3
Já a hidrogenação dos dienos conjugados pode acontecer de duas formas: com adição 1,2 e adição 1,4. A mais comum é a adição 1,2, em que os hidrogênios adicionam-se aos carbonos que realizam a dupla ligação e em temperaturas baixas. Já a adição 1,4 ocorre em temperaturas elevadas e é quando há ressonância e aparecimento de valências livres nos carbonos 1 e 4. Veja exemplos de cada caso:
* Exemplo de adição 1,2 em dienos conjugados:
H2C ═ CH ─ CH ═ CH2 + H2 → H2C ─ CH ─ C ─ CH ═ CH2
│ │
H H
* Exemplo de adição 1,4 em dienos conjugados:
H2C ═ CH ─ CH ═ CH2 + H2 → H2C ─ CH ═ CH ─CH2
│ │
H H
- Hidrogenação de aromáticos: As ligações pi do anel benzênico são quebradas e os átomos de hidrogênio adicionam-se aos carbonos que realizam essas ligações.
A seguir é mostrado esse tipo de hidrogenação total:
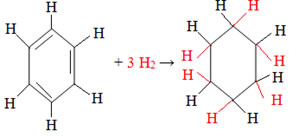
Reação de hidrogenação total do benzeno
- Hidrogenação de ciclanos: Ocorre a formação de um alcano.
Exemplo: Hidrogenação do ciclopropano:
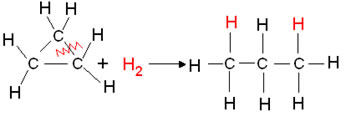
Reação de hidrogenação do ciclopropano
Por Jennifer Fogaça
Graduada em Química
Fonte: Brasil Escola - https://brasilescola.uol.com.br/quimica/reacao-organica-hidrogenacao.htm