Variação de Entalpia de Solução
A variação de entalpia de solução é medida somando-se as entalpias das duas etapas da dissolução de uma substância na água. A primeira etapa nos fornece a entalpia reticular, que é a energia absorvida para romper as ligações dos íons. A segunda é a entalpia de hidratação, em que se libera energia.
Em atividades esportivas, nos hospitais e no nosso dia a dia é muito comum o uso de compressas instantâneas frias e quentes. Em ambos os casos, ocorrem reações de determinadas substâncias com a água. Por exemplo, no caso da compressa fria, ela contém duas cápsulas separando a água do NH4NO3, que, quando se dissolve na água, absorve calor e produz frio instantâneo. Já no caso da compressa quente, quem dissolve na água é o CaCl2 ou o MgSO4, que liberam energia produzindo calor.
Mas por que determinadas soluções liberam calor, sendo exotérmicas; e outras absorvem, sendo endotérmicas?
Bom, para entendermos essa questão temos que estudar a variação de entalpia (ΔH) de soluções, que é composta de duas etapas:
(1ª) Entalpia reticular (ΔHret): quando um soluto se dissolve na água, a primeira etapa é a de separação de seus íons que estão num retículo cristalino. Para romper as ligações entre os íons é necessário que se forneça energia ao sistema. Portanto, esse primeiro processo é endotérmico, pois absorve energia; sendo sua entalpia positiva (ΔH > 0).
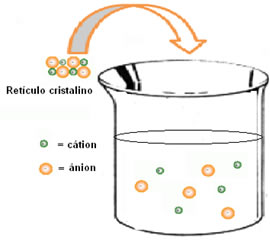
(2ª) Entalpia de hidratação (ΔHhid): depois da separação dos íons, eles são envolvidos pelas moléculas do solvente. No caso da água, ela é o solvente e dizemos que está ocorrendo uma hidratação. Os dipolos da água são atraídos respectivamente pelos íons de carga oposta; assim, para que haja essa interação, é necessária a liberação de energia. Desse modo, na hidratação a entalpia será negativa (ΔH < 0), pois o processo é exotérmico.
Na figura abaixo se vê como ocorre a hidratação, em que há interação íon-dipolo, ou seja, atração entre as cargas dos íons separados e o dipolo da água:
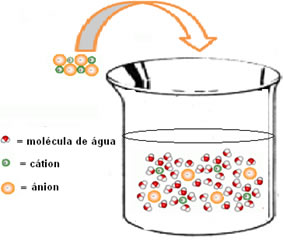
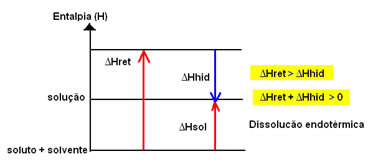
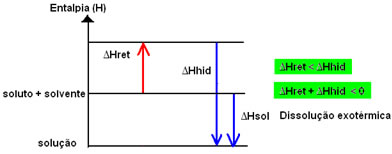
A variação de entalpia da solução (ΔHsol) será determinada pela somatória dessas duas entalpias. Se o resultado der positivo, significa que a entalpia reticular é maior, portanto a entalpia de dissolução indicará que o processo é endotérmico.
O diagrama de entalpia de uma dissolução endotérmica é representado a seguir:
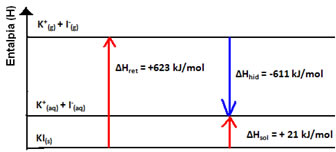
Isso é indicado pelo caso da dissolução do iodeto de potássio mostrado a seguir:
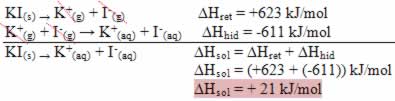
Seu diagrama de entalpia será representado por:
Já se o resultado for positivo, a entalpia de hidratação será maior que a reticular e o processo é exotérmico. Os diagramas de entalpia de dissoluções exotérmicas são representados como mostra o exemplo a seguir:
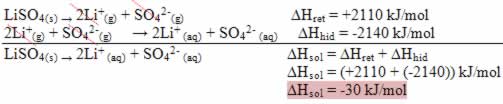
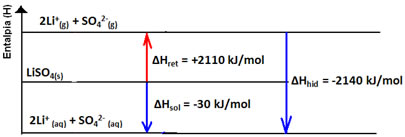
Observe seu diagrama de entalpia abaixo:
Por Jennifer Fogaça
Graduada em Química
Fonte: Brasil Escola - https://brasilescola.uol.com.br/quimica/variacao-entalpia-solucao.htm