Transformação isotérmica ou Lei de Boyle
Um gás sofre uma transformação isotérmica quando há a variação da sua pressão e do seu volume, com a temperatura sendo mantida constante. Nesse caso, surgiu a Lei de Boyle, que diz que a pressão e o volume de um gás são inversamente proporcionais.
Em uma transformação isotérmica, provoca-se a variação do volume e da pressão de determinado gás, porém mantém-se a temperatura constante; daí a origem do nome isotérmico (do grego: iso = igual; thermo = calor).
Os cientistas Boyle e Mariotte, de modo isolado, fizeram experiências semelhantes e o resultado obtido foi: à medida que se aumenta a pressão, o volume do gás diminui.
É só pensarmos, por exemplo, no êmbolo de uma seringa. Se aplicarmos uma pressão externa sobre este êmbolo, ou seja, se aumentarmos a pressão, o volume do ar ocupado dentro da seringa diminuirá, e vice-versa.
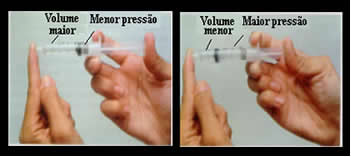
O volume e a pressão são inversamente proporcionais: no quadrinho da esquerda, a pressão é pequena e o volume ocupado pelo ar é grande. Já no da direita, quando se aplica uma maior pressão sobre o êmbolo da seringa, o volume diminui.
Isso não é um caso isolado, é algo que se repete com uma regularidade comum para os gases. Por isso, esse fato foi enunciado na forma de uma lei, que pode ser descrita assim:
| Lei de Boyle ou Lei de Boyle-Mariotte: Sob temperatura constante, o volume ocupado por determinada massa fixa de um gás é inversamente proporcional à sua pressão. |
Isso significa que se dobrarmos a pressão de um gás, seu volume reduzirá pela metade e assim por diante. Quando duas grandezas como essas são inversamente proporcionais, o seu produto é uma constante; desse modo, matematicamente, essa relação pode ser representada assim:
| P.V = k |
Onde k = constante.
Assim, se em uma primeira situação temos o valor da pressão de determinado gás como sendo P1 e seu respectivo volume como V1, então temos que:
| P1 . V1 = k |
Se aumentarmos essa pressão para P2, seu volume também será alterado para V2 e novamente teremos que:
| P2 . V2 = k |
Desse modo, chegamos à conclusão:
| P1 . V1 = P2 . V2 |
Essa constância pode ser vista pelo exemplo dado na tabela abaixo, das pressões e volumes de um gás com massa fixa:
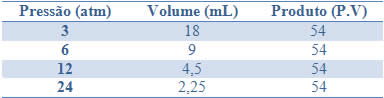
Representando graficamente esses valores, veremos a formação de uma curva.
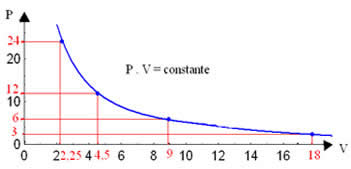
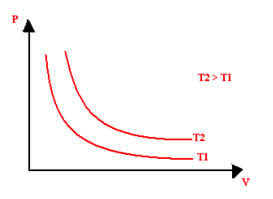
A representação gráfica de uma transformação isotérmica será sempre uma hipérbole, independente dos valores da pressão e do volume e da temperatura em que foi realizado o experimento. Essa hipérbole é chamada de isoterma; de modo que, conforme pode ser visto no gráfico abaixo, diferentes temperaturas originam diferentes isotermas.
Fonte: Brasil Escola - https://brasilescola.uol.com.br/quimica/transformacao-isotermica-ou-lei-boyle.htm