PUBLICIDADE
As unidades de medida são representações das grandezas físicas utilizadas em diversas áreas do conhecimento com o intuito de quantificar uma matéria, uma sensação, o tempo ou o tamanho de algo, por exemplo.
Em todo o mundo as unidades de medida seguem um padrão determinado pelo Sistema Internacional de Unidades (SI). A partir da unidade-padrão estabelecida pelo Sistema Internacional, podemos ainda utilizar outras unidades derivadas dela, o que permite compararmos e ampliarmos a noção quantitativa da grandeza.
O Sistema Internacional adota a unidade kelvin, por exemplo, como padrão para a grandeza temperatura. Essa unidade é muito utilizada em experimentos laboratoriais, mas, no dia a dia, a maioria dos países utiliza a unidade graus Celsius, que é derivada da unidade kelvin.
Leia também: Grandezas vetoriais e escalares
Tópicos deste artigo
- 1 - Unidades de massa
- 2 - Unidades de volume
- 3 - Unidades de pressão
- 4 - Unidades de temperatura
- 5 - Unidades de comprimento
- 6 - Unidades de energia na forma de calor
- 7 - Unidades de tempo
- 8 - Mol (quantidade de matéria)
Unidades de massa
As unidades mais utilizadas para o trabalho com a massa de uma matéria são:
-
Tonelada (t);
-
Quilograma (kg) [unidade-padrão de massa segundo o SI];
-
Grama (g);
-
Miligrama (mg).
Para converter uma unidade em outra, basta seguir estas relações:
-
1 t = 1000 Kg
-
1 kg = 1000 g
-
1 g = 1000 mg
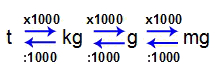
Relação entre as unidades de massa
Como podemos observar, uma unidade de massa é sempre 1000 vezes maior que a outra. Veja alguns exemplos:
→ Conversão de unidades de massa
Exemplo 1: vamos transformar 2,5 kg em gramas.
Como 1 kg equivale a 1000 gramas, podemos montar a seguinte regra de três:
1 kg --------- 1000 g
2,5 Kg---------- x
x . 1 = 2,5.1000
x = 2500 g
Exemplo 2: vamos transformar 4 mg em kg.
Como 1 kg equivale a 1000000 de mg (resultado da multiplicação 1000 x1000 da diferença entre a unidade kg e a mg), podemos montar a seguinte regra de três:
1 kg --------- 1000000 mg
x---------- 4 mg
1000000.x = 4.1
x = 4
10000000
x = 0,000004 Kg
Unidades de volume
-
Metro cúbico (m3) [unidade-padrão de volume segundo o SI];
-
Litro (L) ou decímetro cúbico (dm3);
-
Mililitro (mL) ou centímetro cúbico (cm3).
Para converter uma unidade na outra, basta seguir estas relações:
-
1 m3 = 1000 L
-
1L = 1 dm3
-
1L = 1000 mL
-
1dm3 = 1000 cm3
-
1cm3 = 1mL
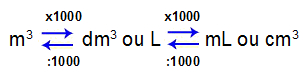
Relação entre as unidades de volume
Como podemos acompanhar no esquema acima, uma unidade de volume é sempre 1000 vezes maior que a outra. Quando comparamos a unidade maior (m3) com a unidade menor (mL ou cm3), a diferença é de 1000000 de vezes.
→ Conversão de unidades de volume
Exemplo 1: vamos transformar 4,5 m3 em dm3.
Como 1 m3 equivale a 1000 dm3, podemos montar a seguinte regra de três:
1m3 --------- 1000 dm3
4,5 m3---------- x
x.1 = 4,5.1000
x = 4500 dm3
Exemplo 2: vamos transformar 300 cm3 em L.
Como 1 L equivale a 1000 de cm3, podemos montar a seguinte regra de três:
1L --------- 1000 cm3
x---------- 300 cm3
1000.x = 300.1
x = 300
1000
x = 0,3 dm3
Unidades de pressão
As unidades mais utilizadas para o trabalho com a pressão são:
-
Atmosfera (atm);
-
Milímetro de mercúrio (mmHg);
-
Centímetro de mercúrio (cmHg);
-
Pascal (Pa) ou quilopascal (KPa = 1000 Pa) [unidade-padrão de pressão segundo o SI].
Para converter uma unidade na outra, basta seguir estas relações:
-
1 atm = 101,325 kPa
-
1 atm = 101325 Pa
-
1 atm = 760 mmHg
-
1 atm = 76 cmHg
OBS.: Foram utilizadas relações partindo do atm porque os valores utilizados são numericamente mais simples de trabalhar e/ou memorizar (caso necessário).
→ Conversão de unidades de pressão
Exemplo 1: vamos transformar 2 atm em KPa.
Como 1 atm equivale a 101,325 KPa, basta montar a seguinte regra de três:
1atm --------- 101,325 KPa
2 atm ---------- x
x.1 = 2.101,325
x = 202, 650 KPa
Exemplo 2: vamos transformar 200 mmHg em cmHg.
Utilizando as relações fornecidas acima, inicialmente devemos converter 200 mmHg para atm por meio da seguinte regra de três:
1 atm --------- 760 mmHg
x ---------- 200 mmHg
x.760 = 200.1
x = 200
760
x = 0,26 atm
Em seguida, transformamos o resultado em atm para cmHg na regra de três a seguir:
1 atm --------- 76 cmHg
0,26 atm ----------y
y.1 = 0,26.76
y = 19,76 cmHg
Exemplo 3: vamos transformar 500 cmHg em KPa.
Utilizando as relações fornecidas acima, inicialmente devemos converter 500 cmHg para atm por meio da seguinte regra de três:
1 atm --------- 76 cmHg
x ---------- 500 cmHg
x.76 = 500.1
x = 500
76
x = 6,57 atm
Em seguida, transformamos o resultado em atm para cmHg na regra de três a seguir:
1 atm --------- 101,325 KPa
6,57 atm ----------y
y.1 = 6,57.101,325
y = 665,70 KPa
Veja também: O que é pressão atmosférica?
Unidades de temperatura
As unidades mais utilizadas para o trabalho com temperatura são:
-
Graus Celsius (oC);
-
Graus Fahrenheit (oF);
-
Kelvin (K) [unidade-padrão de temperatura segundo o SI].
Para converter uma unidade de temperatura em outra, podemos utilizar as fórmulas a seguir:
-
De graus Celsius para Kelvin: TK = ToC + 273
-
De graus Celsius para Fahrenheit: ToC = ToF-32
5 9
→ Conversão de unidades de temperatura
Exemplo 1: vamos transformar 45 oC para oF.
Para realizar a transformação, basta colocar os dados na fórmula abaixo:
ToC = ToF-32
5 9
45 = ToF-32
5 9
5.(ToF-32) = 45.9
5ToF - 160 = 405
5ToF = 405 + 160
ToF = 565
5
ToF = 113 oF
Exemplo 2: vamos transformar 200 K para oC.
Para realizar a transformação, basta colocar os dados na fórmula a seguir:
TK = ToC + 273
200 = ToC + 273
ToC = 200 – 273
ToC = - 73 oC
Para saber mais sobre a conversão de valores entre as escalas termométricas, leia o texto a seguir: Conversão entre escalas termométricas.
Unidades de comprimento
As unidades mais utilizadas para o trabalho com comprimento são:
-
Quilômetro (km);
-
Metro (m) [unidade-padrão de comprimento segundo o SI];
-
Centímetro (cm);
-
Decímetro (dm);
-
Milímetro (mm).
Para converter uma unidade na outra, basta seguir estas relações:
-
1 km = 1000 m
-
1 m = 100 cm
-
1 dm = 10 cm
-
1 cm = 10 mm
→ Conversão de unidades de comprimento
Exemplo 1: vamos transformar 5 km em dm.
Analisando o esquema, a diferença entre km e dm é da ordem de 100000, assim, basta montar a seguinte regra de três:
1 Km --------- 100000 dm
5 Km ---------- x
x.1 = 5.100000
x = 500000 dm
Exemplo 2: vamos transformar 500 mm em cm.
Como 1 cm equivale a 10 mm, basta utilizar a seguinte regra de três:
1 cm --------- 10 mm
x ---------- 500 mm
x.10 = 500.1
x = 500
10
x = 50 cm
Unidades de energia na forma de calor
As unidades mais utilizadas para o trabalho com a energia na forma de calor são:
-
Joule (J) ou quilojoule (KJ = 1000 J) [o joule é a unidade-padrão estabelecida pelo SI];
-
Calorias (cal) ou quilocalorias (Kcal = 1000 cal).
Para converter uma unidade na outra, basta seguir esta seguinte relação:
1 cal = 4,18 J
1Kcal = 4,18 KJ
Veja alguns exemplos:
Exemplo 1: vamos transformar 2600 Kcal em KJ.
Como 1 Kcal equivale a 4,18 KJ, basta utilizar a seguinte regra de três:
1 Kcal --------- 4,18 KJ
2600 Kcal ---------- x
x.1 = 2600.4,18
x = 10868 KJ
Unidades de tempo
-
Hora (h);
-
Minuto (min);
-
Segundo (s) [unidade]padrão de tempo estabelecida pelo SI].
Para converter uma unidade na outra, basta seguir estas relações:
-
1h = 60 min
-
1 min = 60 s

Relação entre as unidades de tempo
→ Conversão de unidades de tempo
Exemplo 1: vamos transformar 6 h em segundos.
Como 1 hora equivale a 3600 segundos (resultado da multiplicação 60x60 da diferença entre horas e segundos), basta montar a seguinte regra de três:
1 h --------- 3600 s
6h ---------- x
x.1 = 6.3600
x = 21600 s
Exemplo 2: vamos transformar 600 s em minutos.
Como 1 minuto equivale a 60 s, basta utilizar a seguinte regra de três:
1 min --------- 60 s
x ---------- 600 s
x.60 = 600
x = 600
x = 600
60
x = 10 min
Mol (quantidade de matéria)
É a unidade que estabelece a quantidade de entidades (átomos, íons, elétrons, nêutrons, moléculas) que formam uma determinada matéria. Segundo Amedeo Avogadro, 1 mol de qualquer matéria contém 6,02.1023 entidades.
Exemplo: 1 mol de H2O.
Um mol da substância água apresenta:
-
6,02.1023 moléculas de água;
-
3.6,02.1023 átomos (o 3 é resultado da soma de 1 oxigênio com 2 hidrogênios);
-
2.6,02.1023 átomos de hidrogênio;
-
1.6,02.1023 átomos de oxigênio.
Por Me. Diogo Lopes Dias







