PUBLICIDADE
Entre as complexidades do estudo atômico está a determinação do tamanho do átomo ou, melhor, o raio atômico. Essa propriedade periódica descreve a distância do núcleo até o elétron mais externo de seus níveis eletrônicos. Para determiná-la, é realizada uma média aritmética da distância entre os núcleos de dois átomos que formam uma substância simples, por exemplo.
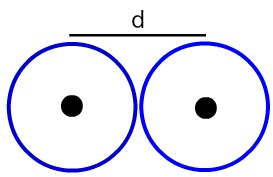
Representação da distância entre dois núcleos atômicos
Vamos determinar o raio atômico (RA) dos átomos exemplificados na imagem. Para isso, basta dividir a distância entre os núcleos por 2:
RA = d
2
O estudo do raio atômico é importante porque favorece a compreensão de alguns acontecimentos físicos (densidade, ponto de fusão, ponto de ebulição e energia de ionização) e químicos (ligações químicas) que ocorrem com os átomos.
Ao analisar uma tabela periódica, podemos avaliar se um átomo é maior ou menor em relação a outro e, assim, determinar se ele apresenta maior ou menor facilidade em ter um ou mais elétrons retirados de seus orbitais. A avaliação e determinação do raio atômico na tabela periódica é realizada segundo dois critérios básicos:
a) Quantidade de níveis de energia (famílias ou grupos/colunas verticais)
Sabemos que os átomos podem apresentar até sete níveis de energia (K, L, M, N, O, P, Q) e que cada elemento químico está situado em famílias ou grupos (colunas verticais) e em períodos (colunas horizontais). Os períodos indicam o número de níveis que o átomo do elemento apresenta, e a família indica o subnível mais energético do átomo. Em um grupo ou família, os elementos químicos diferenciam-se pela quantidade de níveis de energia. Veja a tabela a seguir:
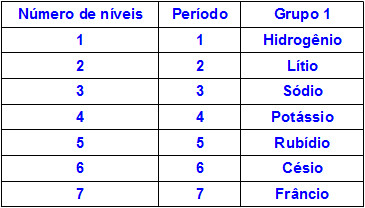
Quanto maior for o número de níveis de energia de um átomo, maior será seu raio atômico. Analisando a tabela acima, observa-se que o frâncio apresenta o maior átomo porque possui sete níveis. Já o átomo de potássio tem menor raio por apresentar quatro níveis de energia. A seguir temos uma representação comparativa entre o átomo de frâncio e o átomo de potássio:
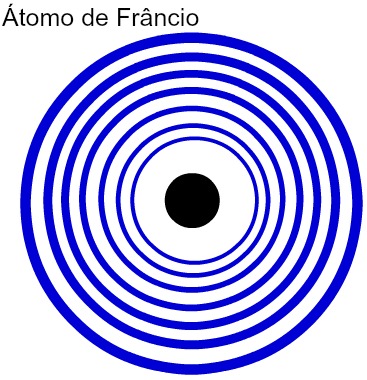
Representação dos sete níveis de energia do átomo de Frâncio

Representação dos quatro níveis de energia do átomo de Potássio
O esquema a seguir representa como ocorre o aumento do raio atômico em uma mesma família ou grupo (colunas verticais) da tabela periódica. Quanto maior for o número de níveis, maior será o raio, ou seja, na tabela periódica, o raio atômico cresce de cima para baixo:
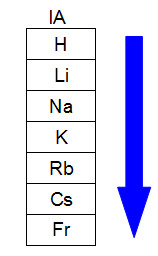
Representação de como o raio atômico aumenta em uma família da tabela periódica
b) Número atômico (Z ou número de prótons) no mesmo período (coluna horizontal)
Quando elementos químicos pertencem ao mesmo período, seus átomos possuem a mesma quantidade de níveis de energia, mas a quantidade de prótons no interior dos seus núcleos é diferente. A seguir temos uma sequência de elementos pertencentes ao quarto período da tabela periódica:
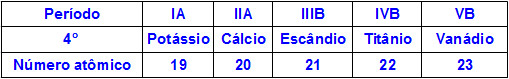
Todos os átomos dos elementos representados na tabela acima possuem quatro níveis de energia, porém cada um deles apresenta uma quantidade de prótons diferente em seus núcleos. Como os prótons no interior do núcleo exercem uma força de atração nos elétrons presentes nos níveis de energia, quanto maior for a quantidade de prótons no núcleo, maior será a atração deles em relação aos elétrons. O resultado é uma aproximação dos níveis em direção ao núcleo, diminuindo o tamanho do átomo.
↑Z = ↓Raio atômico
↓Z = ↑Raio atômico
Dessa forma, podemos afirmar que o raio atômico do elemento potássio é maior do que o do vanádio em razão do menor número de prótons.
O esquema a seguir representa como ocorre o aumento do raio atômico em um mesmo período (linha horizontal). Quanto menor for o número atômico, maior será o raio, ou seja, o raio atômico na tabela cresce da direita para a esquerda
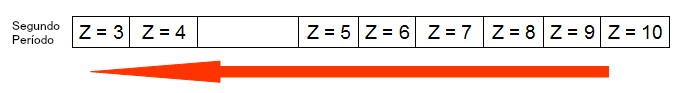
Representação de como o raio atômico aumenta em um período da tabela periódica
Por Me. Diogo Lopes Dia






