PUBLICIDADE
A osmose é a passagem de solvente, de uma solução menos concentrada para uma solução mais concentrada, através de uma membrana semipermeável, até que a pressão exercida pela solução sobre a membrana impeça a passagem de solvente. Esse processo tem por finalidade equilibrar a concentração da solução.
Leia também: Soluto e solvente
Tópicos deste artigo
Pressão osmótica
A pressão osmótica é a pressão exercida sobre a solução com maior concentração para que não ocorra a osmose, ou seja, para que o solvente não atravesse a membrana semipermeável.
A pressão osmótica é utilizada, em processos de dessalinização da água, forçando o processo da osmose ao contrário, fazendo com que o solvente passe da solução mais concentrada para a menos concentrada. A esse processo chamamos osmose reversa. Veja a imagem seguinte que compara os dois processos:
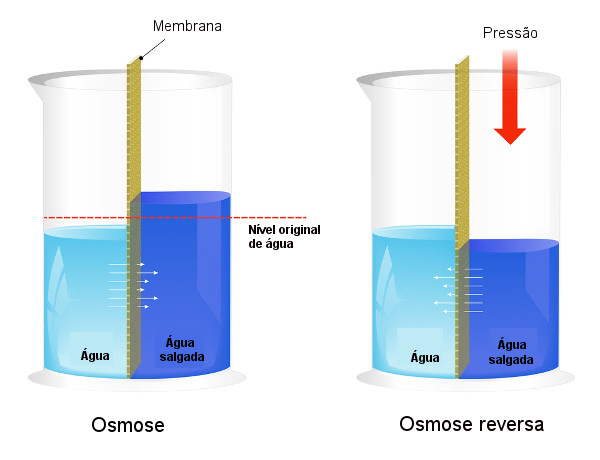
Veja que, na osmose, a passagem do solvente está no sentido da solução mais concentrada e que, na osmose reversa, a passagem está no sentido contrário, devido à pressão aplicada. Para saber mais sobre o tema, leia nosso texto: Pressão osmótica.
Saiba mais: Osmose reversa na dessalinização da água dos mares
-
Equação da pressão osmótica
A pressão osmótica, representada pela letra pi (π) de uma solução, pode ser calculada pela seguinte equação:
![]()
M = concentração em mol/L
R = constante universal dos gases perfeitos
T = temperatura absoluta, em K
Como outras propriedades coligativas, a pressão osmótica depende da concentração da solução, isto é, quanto maior a concentração da solução, maior será o efeito da osmose nas soluções e, por isso, maior será a pressão osmótica.
Exemplos
A osmose aparece em nosso cotidiano em diversos momentos. Podemos citar o exemplo do processo de salgar carnes para a sua conservação. Os micro-organismos que causariam a degradação da carne perdem água do seu interior para o meio externo, que está com concentração de sal, fazendo com que o alimento dure mais tempo.
Devido ao sal, também acontece de as folhas de uma salada murcharem por perderem água do interior de suas células (meio menos concentrado) para a solução temperada no meio externo.
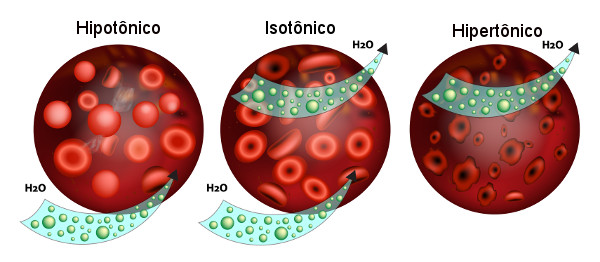
A osmose também tem importância quando falamos do sangue humano. Dizemos que as hemácias e o sangue são um meio isotônico, ou seja, possuem a mesma pressão osmótica, permitindo a entrada e saída de água da célula com facilidade.
No entanto, quando o sangue torna-se menos concentrado que o interior das hemácias (meio hipotônico), ocorrerá a passagem de água com maior facilidade para o interior da célula, fazendo-a inchar até estourar. Caso o sangue chegue a uma concentração maior do que a concentração da hemácia (meio hipertônico), as células do sangue murcham, pois perdem água.
Pelo mesmo princípio da conservação de carnes, ocorre a conservação de frutas nas compotas de doces, que conservam os alimentos devido à alta concentração de açúcar na solução.
A seguir, outros exemplos em que ocorre a osmose:
- na ascensão de seiva nos vasos condutores das plantas;
- na hemodiálise;
- na passagem seletiva de nutrientes nas células do corpo humano.
Para entender como a osmose acontece na célula animal, na célula vegetal e outras questões biológicas, leia: Osmose: o que é e como ocorre na célula animal e vegetal.
Por Victor Ferreira
Professor de Química






