PUBLICIDADE
De uma forma geral, as substâncias puras dificilmente são encontradas isoladas na natureza, sendo encontradas na forma de misturas, isto é, associadas às outras substâncias. Isso quer dizer que nós e quase tudo que está a nossa volta são exemplos de misturas das mais variadas substâncias puras.
Neste texto vamos aprender o que é e quais são as classificações das substâncias puras e misturas.
Substâncias puras
Substâncias puras são materiais que possuem composição química e propriedades físicas e químicas constantes, já que não se modificam em pressão e temperatura constantes.
De uma forma geral, as substâncias puras podem ser classificadas de duas formas:
a) Substâncias simples
São compostos químicos formados por átomos de um mesmo elemento químico. Por exemplo:
→ H2 (Gás Hidrogênio)
As moléculas do Gás Hidrogênio são formadas por dois átomos do elemento químico Hidrogênio, por isso, trata-se de uma substância simples.
→ O3 (Gás Ozônio)
As moléculas do Gás Ozônio são formadas por três átomos do elemento químico Oxigênio, por isso, trata-se de uma substância simples.
Existe ainda a possibilidade de átomos de um mesmo elemento químico formarem substâncias simples completamente diferentes, os alótropos. Um exemplo de alotropia é o caso do elemento químico Oxigênio, o qual forma as substâncias gás oxigênio (O2) e gás ozônio (O3).
São compostos químicos formados por átomos de elementos químicos diferentes. Exemplos:
→ CO2 (Gás Carbônico ou Dióxido de Carbono)
As moléculas do Gás Carbônico são formadas por um átomo do elemento carbono e dois átomos do elemento oxigênio. Como os elementos químicos são diferentes, trata-se de uma substância composta.
→ KMnO4 (permanganato de potássio)
O íon-fórmula do permanganato de potássio é formado por um átomo do elemento potássio, um átomo do elemento manganês e quatro átomos do elemento oxigênio.
Tópicos deste artigo
Mapa Mental: Substância Pura e Mistura
.jpeg)
* Para baixar o mapa mental em PDF, clique aqui!
Misturas
Mistura é a união de duas ou mais substâncias diferentes (independentemente se são simples ou compostas). Ela apresenta características físicas (ponto de fusão, ponto de ebulição, densidade, tenacidade etc.) diferentes e variáveis (não fixas) em comparação com as substâncias que a compõem.
A mistura de água e cloreto de sódio, por exemplo, apresenta um ponto de fusão totalmente diferente em relação aos pontos de fusão da água ( 0oC) e do cloreto de sódio (803oC) isoladamente.
a) Misturas homogêneas
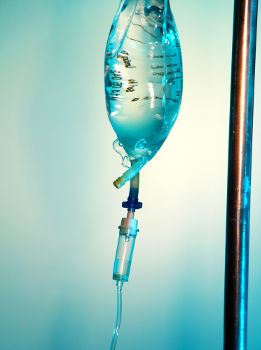
O soro fisiológico é uma mistura homogênea formada por água, glicose e cloreto de sódio
As misturas homogêneas apresentam apenas uma fase (um único aspecto visual). São formadas quando um material tem a capacidade de dissolver outro. Exemplos:
-
água e cloreto de sódio;
-
água e glicose;
-
gasolina e etanol;
-
ar atmosférico (gás oxigênio, gás nitrogênio, gás carbônico, vapor de água etc);
-
ácido acético e água;
-
petróleo (gasolina, querosene, óleo lubrificante etc.);
-
soro fisiológico.
b) Misturas heterogêneas

O leite é uma mistura heterogênea porque possui uma fase líquida (água) e uma fase sólida (gordura)
As misturas heterogêneas apresentam mais de uma fase (dois ou mais aspectos visuais). São formadas quando um material não dissolve outro. Exemplos:
-
Granito;
-
Leite;
-
Sangue;
-
Água e areia;
-
Água e óleo;
-
Água e gasolina.
* Mapa mental por Victor Ricardo Ferreira
Professor de Química
Por Me. Diogo Lopes Dias







