PUBLICIDADE
- Meio neutro:
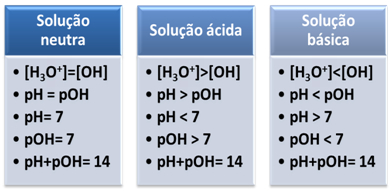
Um meio é considerado neutro se possuir a mesma concentração, em mol/L, dos íons hidrônio (H3O+) e hidróxido (OH-).
Um exemplo de meio neutro e que serve inclusive de padrão para as demais soluções é a água pura e destilada à temperatura de 25ºC. Nessa temperatura, ela possui exatamente 1 . 10-7 mol/L de ambos os íons. Por isso, o seu produto iônico (Kw) é igual a 10-14 (mol/L)2:
Kw = [H3O+] . [OH-]
Kw = (1 . 10-7 mol/L) . (1 . 10-7 mol/L) = 10-14 (mol/L)2
O pH e o pOH são dados abaixo:
pH= - log [H3O+] pOH= - log [OH-]
pH= - log 1 . 10-7 pOH= - log 1 . 10-7
pH = 7 pOH = 7
Isso nos mostra que, em uma solução neutra, o pH é igual ao pOH.
- Meio ácido:
No meio ácido, a concentração dos íons H3O+ é maior que a dos íons OH-.
Uma solução assim pode ser conseguida adicionando-se uma pequena parte dos íons H3O+, por exemplo, por meio de um ácido.
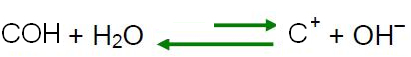
Segundo o princípio de Le Chatelier, quando se causa alguma perturbação em um sistema em equilíbrio, este tende a se reajustar de modo a diminuir os efeitos dessa força. Isso significa que se um ácido for adicionado à água, os íons H3O+ ficarão em excesso e o equilíbrio irá se deslocar no sentido da reação inversa, para a esquerda. Então, esses íons em excesso reagirão com os íons OH-. Dessa forma, a concentração dos íons OH- diminuirá e a solução se tornará ácida.

O produto iônico (Kw) é sempre igual a 10-14, porém a concentração dos íons H3O+ é maior que a concentração dos íons OH-1. Portanto, o pH é maior que o pOH em meio ácido, mas a sua soma sempre dá igual a 14.
Além disso, quanto maior for a concentração dos íons H3O+, maior é o valor do pH. Em temperatura ambiente (25ºC), pH < 7 e pOH > 7.

- Meio básico:
No meio básico, a concentração dos íons OH- é maior que a dos íons H3O+.
Se adicionarmos uma base na água, significa que estaremos adicionando íons OH- e, conforme explicado no item anterior, pelo princípio de Le Chatelier, o equilíbrio da reação de autoionização da água se deslocará para o sentido inverso, sendo que os íons em excesso reagirão com os íons H3O+, diminuindo a sua concentração e tornando a solução básica.
Nesse caso, o pOH será maior que o pH. Em temperatura ambiente (25ºC), pH > 7 e pOH < 7.
.jpg)
Resumidamente:
Por Jennifer Fogaça
Graduada em Química