PUBLICIDADE
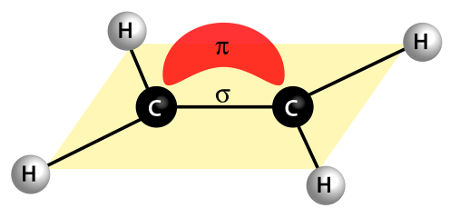
A ligação pi, que pode ser representada pelo símbolo π, é um tipo de ligação covalente que está presente em átomos capazes de realizar duas ou mais ligações químicas. Ela ocorre em uma ligação dupla ou tripla entre dois átomos.

Uma ligação dupla possui sempre uma ligação sigma (representada pelo símbolo σ) e uma ligação pi (π). A ligação tripla apresenta uma ligação sigma e duas ligações pi.
Como toda ligação covalente, a ligação pi (π) é uma interpenetração de dois orbitais atômicos incompletos – especificamente de orbitais atômicos incompletos do tipo p.
Orbitais atômicos incompletos
Orbitais são a região do átomo capaz de abrigar até dois elétrons com spins contrários. Quando estão incompletos, apresentam apenas um elétron, independentemente do subnível em que estão (s, p, d, f).
Veja a quantidade de orbitais nos subníveis:
-
Subnível s = um orbital. Abriga, no máximo, dois elétrons; assim, pode ter apenas um elétron desemparelhado.

Subnível s com o seu orbital incompleto
-
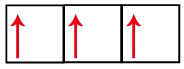
Subnível p = três orbitais. Abriga, no máximo, seis elétrons; assim, pode ter até três elétrons desemparelhados.
Subnível p com o seu orbital incompleto
Como a ligação pi não envolve os subníveis d e f, não vamos representá-los neste texto.
Representação dos orbitais do subnível p:
.jpg)
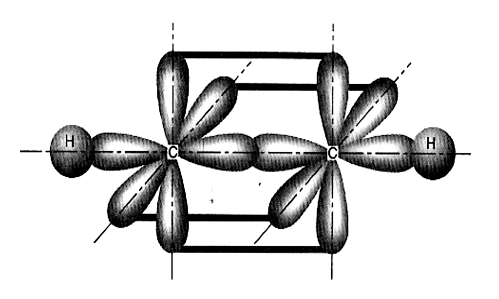
Formação de uma ligação pi
Para que a ligação pi ocorra, é necessário que cada um dos átomos envolvidos na ligação apresente pelo menos um orbital paralelo ao orbital p do outro átomo. Isso ocorre apenas entre os orbitais y e z (representados na imagem acima).
.jpg)
Representação dos orbitais paralelos
Quando dois átomos de oxigênio ligam-se, por exemplo, são necessárias duas ligações, haja vista que os oxigênios apresentam dois orbitais atômicos incompletos, como podemos observar na sua distribuição eletrônica fundamental e também nos orbitais do subnível mais energético (2p).
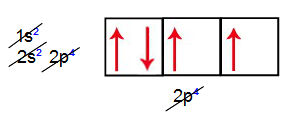
Um dos orbitais (eixo horizontal) incompletos realiza a ligação sigma (σ), que ocorre com a interpenetração de orbitais no mesmo eixo. No outro orbital (eixo vertical) de cada oxigênio, ocorre a interpenetração no eixo paralelo, o que caracteriza a ligação pi (π).
.jpg)
Representação das ligações químicas presentes na molécula do gás oxigênio (O2)
Por Me. Diogo Lopes Dias