PUBLICIDADE
O Hidrogênio é o elemento químico de menor massa atômica (1 u) e menor número atômico (Z=1) entre todos os elementos conhecidos até hoje. Diferentemente de todos os outros elementos, não apresenta similaridade com as características de nenhuma das famílias periódicas, ou seja, não pertence a nenhum grupo ou família da tabela.
Grande parte das tabelas periódicas posiciona o Hidrogênio na família IA (metais alcalinos), em virtude da semelhança em relação ao subnível mais energético do grupo, que é o s1.
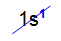
Distribuição eletrônica de um átomo de Hidrogênio
O Hidrogênio é o elemento químico mais abundante de todo o universo, já que é o combustível de toda estrela, como o sol. Na Terra, ele é o quarto mais abundante, perdendo apenas para o Oxigênio (1º lugar), Silício (2º lugar) e Alumínio (3º lugar).
De uma forma geral, participa da composição de diversos tipos de substâncias orgânicas e inorgânicas. Quando não participa de substâncias químicas, ele é encontrado exclusivamente na forma molecular (dois átomos de hidrogênio ligados por uma ligação covalente simples), cuja fórmula é H2. Por isso, vamos dar ênfase nas características e propriedades do hidrogênio molecular, e não do hidrogênio atômico (isolado).
→ Características físicas do Hidrogênio
As características físicas do hidrogênio molecular são:
-
Ponto de fusão: -259,2oC;
-
Ponto de ebulição: -252,9 oC;
-
Em temperatura ambiente, é um gás;
-
Por ser um gás, não pode ser visto;
-
Pode tornar-se um cátion monovalente;
-
Pode tornar-se um ânion monovalente;
-
Não possui odor (inodoro);
-
Suas moléculas são apolares;
-
Suas moléculas interagem por meio de forças dipolo induzido.
→ Características químicas
a) Quanto à estabilidade atômica
A estabilidade do átomo de Hidrogênio é alcançada quando ele recebe um elétron na camada de valência. É um elemento químico que não se encaixa na classificação dos metais, ametais e gases nobres. Para estabilizar-se, realiza ligações iônicas ou covalentes.
-
Nas ligações iônicas (interage exclusivamente com metais), ganha sempre um elétron do metal ao qual se liga;
Não pare agora... Tem mais depois da publicidade ;) -
Nas ligações covalentes (interage com ametais ou com ele mesmo), realiza apenas uma ligação simples.
b) Capacidade de reagir quimicamente com outras substâncias
O hidrogênio molecular (H2) possui grande afinidade química com diversos compostos, participando de reações como:
→ Métodos de obtenção
O hidrogênio molecular pode ser obtido por meio de alguns processos químicos, a saber:
a) Simples troca entre metais e ácidos inorgânicos
Quando um ácido inorgânico reage com um metal, podemos ter a formação de hidrogênio molecular se o metal utilizado como reagente for menos eletropositivo do que o hidrogênio, o que pode ser constatado na ordem decrescente de eletropositividade abaixo:
Metais nobres < H < Metais não nobres < IIIA < IIA < IA
Assim, se o metal for mais eletropositivo, desloca o hidrogênio, ou seja, retira o hidrogênio do ácido, e interage com o ânion do ácido, saindo o hidrogênio na forma molecular (H2), como na equação abaixo:
2 Al+ 3 H2SO4 → Al2(SO4)3 + 3 H2
Exemplo: Hidratação do gás metano
Quando o gás metano é misturado com a água, e a mistura é aquecida a elevadas temperaturas (em torno de 1000oC), o gás hidrogênio é produzido com monóxido de carbono ou dióxido de carbono:
CH4 + H2O → CO + H2
CH4 + H2O → CO2 + H2
b) Hidratação do coque
Quando o carvão coque (subproduto do carvão mineral) é misturado com a água, também a elevadas temperaturas, temos a formação de monóxido de carbono e hidrogênio molecular:
C + H2O→ CO + H2
→ Utilizações
-
Combustível para foguetes espaciais ou carros;
-
Maçaricos de arco voltaico (utilizam energia elétrica) para cortar metais;
-
Soldas;
-
Sínteses orgânicas, mais precisamente em reações de hidrogenação de hidrocarbonetos, com exceção dos alcanos;
-
Reações orgânicas que transformam gorduras em óleos vegetais;
-
Produção de haletos de hidrogênio ou ácidos hidrogenados;
-
Produção de hidretos metálicos, como o hidreto de sódio (NaH).
Por Me. Diogo Lopes Dias






