PUBLICIDADE
Os fatores que alteram a velocidade das reações químicas são a concentração dos reagentes, a superfície de contato dos reagentes, a temperatura e a presença de catalisador. Vale lembrar que as reações químicas são processos de transformação que ocorrem mediante a colisão efetiva entre as partículas dos reagentes ao atingirem determinado nível de energia e que alguns parâmetros podem ser alterados a fim de aumentar a ocorrência dessas colisões efetivas ou de diminuir a barreira energética.
Leia também: Transformações da matéria — as modificações que a matéria pode sofrer com ou sem mudança de sua composição
Tópicos deste artigo
- 1 - Resumo sobre os fatores que alteram a velocidade das reações químicas
- 2 - Videoaula sobre os fatores que alteram a velocidade das reações químicas
- 3 - Quais são os fatores que alteram a velocidade das reações químicas?
- 4 - Importância dos fatores que alteram a velocidade das reações químicas
- 5 - Exercícios resolvidos sobre os fatores que alteram a velocidade das reações químicas
Resumo sobre os fatores que alteram a velocidade das reações químicas
-
As reações químicas ocorrem mediante a colisão efetiva das partículas dos reagentes.
-
Alguns parâmetros podem ser alterados para aumentar o número de colisões efetivas.
-
O aumento da concentração dos reagentes eleva a quantidade de colisões entre moléculas, átomos ou íons, acelerando a reação.
-
Substâncias com maior área de contato disponível para a ocorrência da reação aceleram o processo de transformação.
-
Reações químicas geralmente ocorrem mais rapidamente com a elevação de temperatura.
-
Catalisadores diminuem a energia de ativação para a ocorrência de uma reação química, tornando-a mais rápida.
Videoaula sobre os fatores que alteram a velocidade das reações químicas
Quais são os fatores que alteram a velocidade das reações químicas?
As reações químicas acontecem quando as moléculas dos reagentes colidem entre si, sofrendo uma transformação química. As taxas nas quais os reagentes são consumidos e os produtos são formados durante uma reação química variam em uma ampla gama de escalas de tempo. Alguns processos químicos ocorrem instantaneamente, como a detonação de uma bomba ou de fogos de artifício, enquanto outros ocorrem no decorrer de anos, tal como o enferrujamento de uma peça de ferro.

Existem quatro principais fatores conhecidos por alterar a velocidade com que as reações químicas acontecem: concentração dos reagentes, superfície de contato dos reagentes, temperatura, e presença de catalisador. Veremos sobre cada um deles a seguir.
→ Concentração de reagentes
Aumentando a concentração de um ou mais reagentes, a velocidade da reação também é aumentada. Isso ocorre porque a maior concentração dos reagentes implica maior quantidade de partículas em um mesmo volume, com isso, eleva-se a quantidade de colisões efetivas, as quais são responsáveis pela ocorrência das reações químicas.
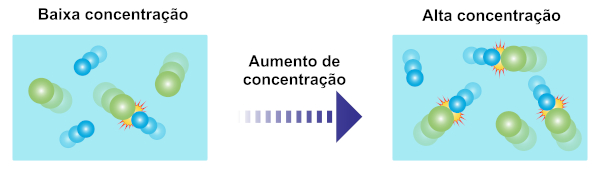
Tratando-se de substâncias gasosas, considera-se a elevação de pressão como fator que acelera os processos químicos.
→ Superfície de contato
De modo geral, as reações químicas acontecem na interface entre duas fases, exceto para gases e substâncias em solução. Dessa forma, a velocidade de um processo químico depende da superfície de contato entre as fases que reagirão.
Uma mesma massa de determinada substância possui maior área de superfície disponível para reagir quando se encontra finamente dividida ou triturada, em comparação a quando está sob a forma de um grande pedaço.
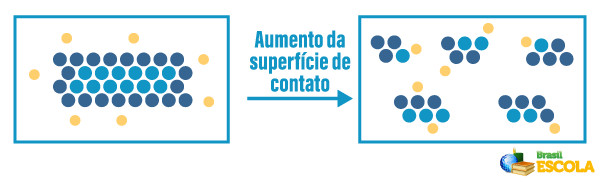
Dessa forma, uma reação com um material pulverizado ocorre de forma muito mais rápida do que com um grande pedaço desse mesmo material.

Por exemplo, grandes peças de ferro reagem lentamente com ácidos. Já ferro finamente dividido reage de modo muito mais rápido. Outra verificação disso é a reação de queima da madeira. Pedaços grandes de madeira ardem lentamente, enquanto lascas de madeira ou serragem queimam muito rapidamente.
→ Temperatura
A maior parte das reações químicas ocorre de forma mais rápida em temperaturas maiores. A elevação de temperatura acelera a movimentação das partículas (moléculas, átomos ou íons), que acabam se chocando umas contra as outras com maior frequência, aumentando a probabilidade de ocorrência de uma colisão efetiva, condição necessária para que ocorra a reação química.
Os exemplos mais clássicos do efeito da temperatura são a conservação e o cozimento de alimentos. Uma porção de alimentos pode sofrer decomposição rapidamente se estiver sem refrigeração, enquanto esse mesmo alimento pode ser mantido por vários dias se acondicionado em geladeira.

Em relação ao cozimento de um alimento, esse processo pode ser acelerado com o uso de uma panela de pressão, pois, nesse caso, alcança-se maiores temperaturas do que o ponto de ebulição da água.
→ Presença de catalisador
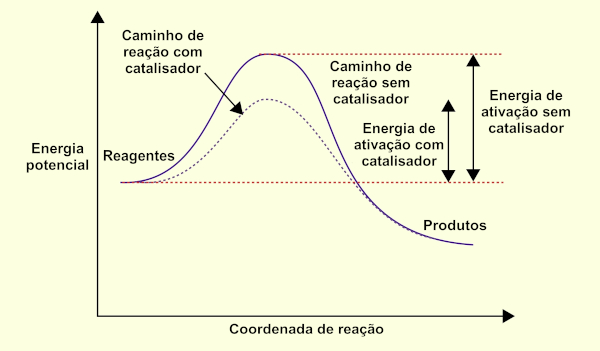
Um catalisador é uma substância que aumenta a velocidade de ocorrência de uma reação química pela redução da sua energia de ativação, sem ser consumido na reação. A energia de ativação é a quantidade mínima de energia requerida para que a reação aconteça.
O catalisador aumenta a velocidade de uma reação porque fornece um caminho ou mecanismo alternativo para a reação prosseguir que envolva uma energia de ativação mais baixa.
Importante: Outros fatores que também podem interferir na velocidade das transformações químicas são a natureza dos reagentes e a presença de luz. A natureza química dos reagentes é relevante, pois o número de ligações químicas a serem rompidas e a força dessas ligações afetam a velocidade dos processos. A presença de luz pode impactar alguns processos químicos. Por exemplo, o peróxido de hidrogênio (H2O2), popularmente conhecido como água oxigenada, sofre decomposição se exposto à luz solar. Esse processo se torna muito mais lento se o H2O2 for armazenado em frascos opacos.
Veja também: De que forma atuam as substâncias catalisadoras?
Importância dos fatores que alteram a velocidade das reações químicas
O conhecimento dos fatores que alteram a velocidade das reações é muito importante, pois existem processos que desejamos que ocorram com maior ou menor velocidade.
O controle da velocidade de reações é especialmente importante em indústrias, onde a eficiência dos processos e produção impacta diretamente no lucro e na produtividade.
O conhecimento da velocidade das reações também é imprescindível no cotidiano, desde o cozimento e preservação de alimentos, até o retardamento de processos corrosivos, por exemplo. A aplicação de tintas em peças de ferro tem a função de diminuir a área de contato da peça com a atmosfera oxidante e, assim, diminuir a velocidade da reação de enferrujamento.
Em organismos vivos, muitas enzimas atuam como catalisadores, acelerando diferentes processos. Um deles é o da digestão de alimentos, existindo diferentes enzimas responsáveis pela degradação dos diversos tipos de substâncias ingeridas.
Exercícios resolvidos sobre os fatores que alteram a velocidade das reações químicas
Questão 1
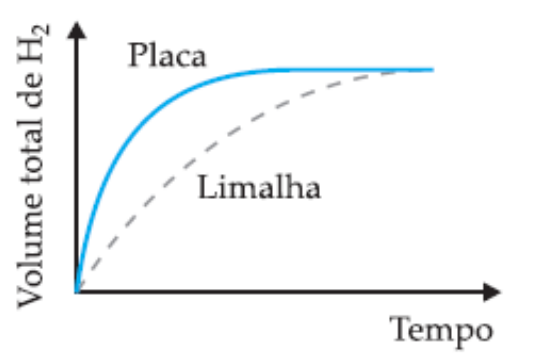
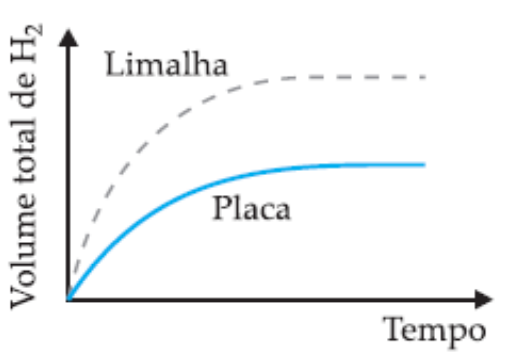
(UFMG) Em dois experimentos, massas iguais de ferro reagiram com volumes iguais da mesma solução aquosa de ácido clorídrico, à mesma temperatura. Num dos experimentos usou-se uma placa de ferro; noutro, a mesma massa de ferro, na forma de limalha. Nos dois casos, o volume total de gás hidrogênio produzido foi medido, periodicamente, até que toda a massa de ferro fosse consumida.
Assinale a alternativa cujo gráfico melhor representa as curvas do volume total do gás hidrogênio produzido em função do tempo.
A)
B)
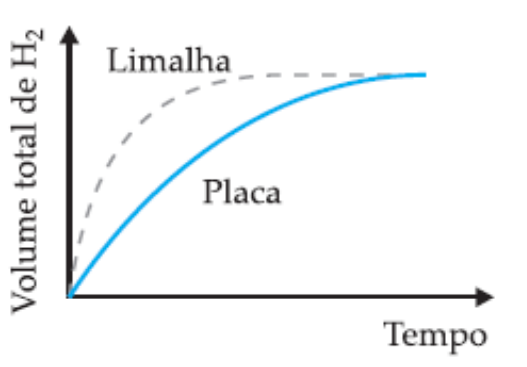
C)
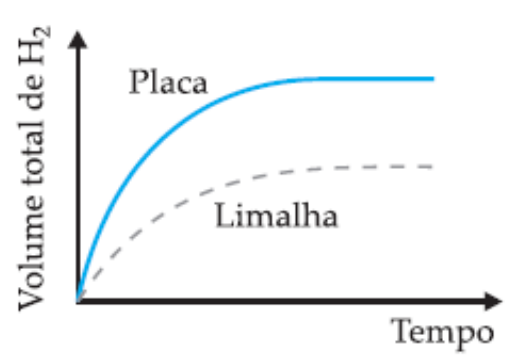
D)
Resolução:
Alternativa B
A velocidade das reações é afetada pela superfície de contato dos reagentes. Nos experimentos propostos, a reação que tem como reagente a limalha de ferro (ferro triturado) reagirá de forma mais rápida em relação à placa de ferro, mesmo as duas amostras possuindo igual massa inicial. Entendendo isso, descartam-se as alternativas A e C, que indicam reação mais rápida para o reagente na forma de placa.
Entre as alternativas B e C, a diferença é a quantidade de H2 formado durante a reação. No enunciado é informado que as massas de reagentes para os dois experimentos são as mesmas, ou seja, a massa de produto formado também será igual, sendo a única diferença o tempo total entre as reações. Portanto, a alternativa B está correta.
Questão 2
(Enem) Alguns fatores podem alterar a rapidez das reações químicas. A seguir destacam-se três exemplos no contexto da preparação e da conservação de alimentos:
-
A maioria dos produtos alimentícios se conserva por muito mais tempo quando submetida à refrigeração. Esse procedimento diminui a rapidez das reações que contribuem para a degradação de certos alimentos.
-
Um procedimento muito comum utilizado em práticas de culinária é o corte dos alimentos para acelerar seu cozimento, caso não se tenha uma panela de pressão.
-
Na preparação de iogurtes, adicionam-se ao leite bactérias produtoras de enzimas que aceleram as reações envolvendo açúcares e proteínas lácteas.
Com base no texto, quais são os fatores que influenciam a rapidez das transformações químicas relacionadas aos exemplos 1, 2 e 3 respectivamente?
A) Temperatura, superfície de contato e concentração.
B) Concentração, superfície de contato e catalisadores.
C) Temperatura, superfície de contato e catalisadores.
D) Superfície de contato, temperatura e concentração.
E) Temperatura, concentração e catalisadores.
Resolução:
Alternativa C
A refrigeração de alimentos reduz a velocidade das reações de degradação por microrganismos, sendo esse um efeito de temperatura.
Cortar alimentos em pedaços menores acelera o seu cozimento, pois há um aumento da superfície de contato, acelerando a reação química.
Na preparação de iogurtes, as enzimas atuam como catalisadores das reações de quebra de açúcares, tornando essas reações químicas muito mais rápidas.
Por Ana Luiza Lorenzen Lima
Professora de Química







