PUBLICIDADE
Considere a reação reversível genérica abaixo, onde as letras minúsculas correspondem aos coeficientes da reação balanceada e as letras maiúsculas são os reagentes e os produtos são todos gasosos:

Considerando separadamente cada um dos sentidos da reação, as taxas de desenvolvimento (Td) delas são dadas por:
*Reação direta: aA + bB → cC + dD
Tddireta = Kdireto . [A]a. [B]b
*Reação inversa: cC + dD → aA + bB
Tdinversa = Kinverso . [C]c. [D]d
A constante do equilíbrio químico em termos de concentração em quantidade de matéria (Kc) e em termos de pressão parcial (Kp) será dada pela divisão do Kdireto pelo Kinverso.
Assim, temos:
Kdireto . [A]a. [B]b = 1 → Kdireto__ = __[C]c. [D]d___
Kinverso . [C]c. [D]d Kinverso [A]a. [B]b
Sendo, Kc =_Kdireto_
Kinverso
Então, temos:
|
Kc =__[C]c. [D]d___ ou Kp =__(pC)c. (pD)d___ |
Onde p é a pressão parcial de cada substância no equilíbrio.
Desse modo, cada concentração é elevada a um expoente correspondente ao coeficiente da respectiva substância na reação, e Kc não apresenta unidade*.
Além disso, um aspecto muito importante a ser ressaltado é que nessa expressão não devem ser representados componentes sólidos e nem líquidos puros, pois somente matérias que podem sofrer variação é que participam dessa expressão. A concentração em quantidade de matéria de uma substância no estado sólido é constante e assim já está incluída no próprio valor de Kc. O mesmo vale para líquidos puros como a água. Resumindo, só participam da expressão substâncias no estado gasoso e em solução aquosa.
Observe os exemplos abaixo:
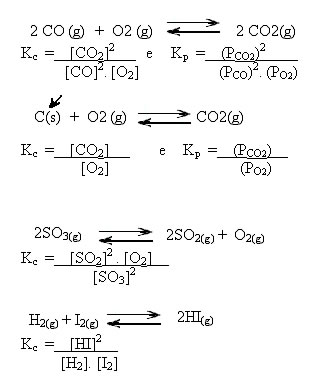
Os valores de Kc podem nos mostrar se a concentração dos reagentes e dos produtos são iguais ou se uma é maior que a outra:
- Se Kc ou Kp for igual a um (Kc = 1), isto significa que a concentração dos reagentes e dos produtos é igual;
- Se o valor de Kc ou Kp for alto, isto significa que os produtos estão em maior concentração, pois na expressão de Kc os produtos estão no numerador;
- Se o valor de Kc ou Kp for baixo, isto significa que os reagentes estão em maior concentração, pois na expressão de Kc os reagentes estão no denominador.
* Kc e Kp são números adimensionais, ou seja, números puros, sem unidade relacionada a alguma grandeza ou relação entre grandezas.
Por Jennifer Fogaça
Graduada em Química







