PUBLICIDADE
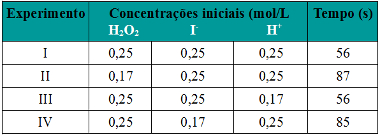
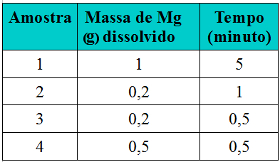
Podemos notar que sempre que aumentamos a concentração de um ou de todos os reagentes participantes de uma reação química, ocorre aumento de sua taxa de desenvolvimento, isto é, a velocidade da reação.
O contrário também é verdadeiro. Por exemplo, atualmente está sendo recomendado que utilizemos o álcool gel no lugar do álcool comum, pois há um menor risco dele entrar em combustão e, assim, evitam-se acidentes. O álcool líquido comum é na realidade uma mistura de álcool e água, sendo que o álcool gel contém uma menor quantidade de álcool. Portanto, quando se diminui a concentração de um dos reagentes da combustão, no caso do álcool, a reação se processa mais lentamente. Em contrapartida, quanto mais puro estiver o álcool, mais rápida será a reação de combustão.

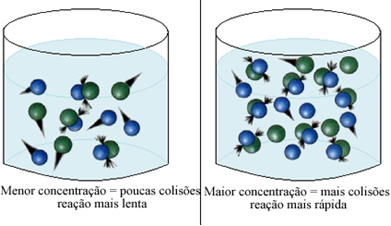
Conforme dito no texto Condições para Ocorrência de Reações Químicas, uma das condições para que uma reação se processe é a colisão efetiva entre as partículas. Assim, o aumento da concentração dos reagentes faz com que se tenha uma maior quantidade de partículas ou moléculas confinadas num mesmo espaço. Isso aumenta a quantidade de choques entre elas e aumenta também a probabilidade de ocorrerem colisões eficazes que resultem na ocorrência da reação. O resultado é que a reação ocorre com maior rapidez.
Para constatar isso, pense no seguinte exemplo:quando temos uma brasa queimando e queremos que essa combustão se processe mais rapidamente, nós assopramos ou abanamos a brasa? Por que isso funciona?
Bem, um dos reagentes dessa reação de combustão é o oxigênio do ar. Quando abanamos, a corrente de ar retira a cinza que está sendo formada na combustão e isso facilita o contato do oxigênio com a brasa. Dessa forma, aumentamos o contato entre os reagentes e aceleramos a reação de combustão.
Resumidamente, temos:
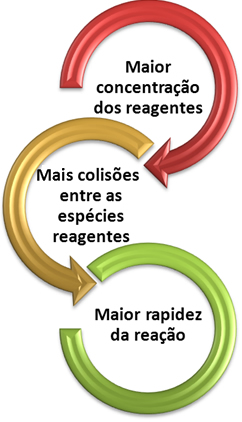
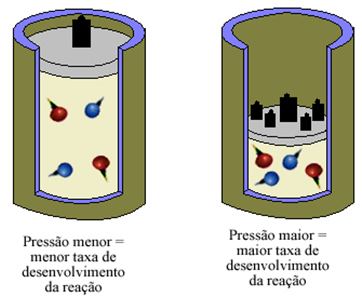
Quando trabalhamos com gases, uma forma de aumentar a concentração dos reagentes é diminuir a pressão. Quando fazemos isso, diminuímos o volume e, consequentemente, há um aumento nas concentrações dos reagentes.
Por Jennifer Fogaça
Graduada em Química