PUBLICIDADE
Os alcanos são uma classe de hidrocarbonetos em que todos os carbonos possuem hibridização sp³, ou seja, realizam apenas ligações simples e, assim, possuem geometria tetraédrica. Além disso, os alcanos possuem cadeia carbônica aberta. Por serem hidrocarbonetos, devemos lembrar que os alcanos possuem apenas carbono e hidrogênio em sua constituição.
Os alcanos possuem fórmula geral CnH2n+2, são apolares e, por isso, insolúveis em água. Os pontos de fusão e ebulição dos alcanos aumentam conforme a cadeia carbônica aumenta. São pouco reativos e obtidos do petróleo e do gás natural basicamente. Entre suas aplicações, destaca-se a utilização como combustíveis fósseis.
Leia também: Benzeno – composto classificado como hidrocarboneto aromático
Tópicos deste artigo
- 1 - Resumo sobre alcanos
- 2 - Videoaula sobre hidrocarbonetos
- 3 - Propriedades dos alcanos
- 4 - Nomenclatura dos alcanos
- 5 - Fórmula dos alcanos
- 6 - Fontes de obtenção de alcanos
- 7 - Aplicações dos alcanos
- 8 - Exercícios resolvidos sobre alcanos
Resumo sobre alcanos
- Os alcanos são hidrocarbonetos saturados de cadeia aberta.
- Todos os carbonos dos alcanos possuem hibridização sp³ e geometria tetraédrica.
- São pouco reativos e insolúveis em água, uma vez que são apolares.
- São menos densos que a água.
- Seus pontos de fusão e ebulição aumentam conforme o volume molecular aumenta.
- Como todo hidrocarboneto, os alcanos possuem sufixo -o, mas, como têm apenas ligações simples, possuem infixo -an- na nomenclatura oficial.
- Obedecem à fórmula geral CnH2n+2.
- São encontrados no petróleo e gás natural.
Videoaula sobre hidrocarbonetos
Propriedades dos alcanos
Os alcanos são hidrocarbonetos saturados, ou seja, os carbonos realizam apenas ligações simples entre si. Sendo assim, todos os carbonos possuem hibridização sp³ e geometria tetraédrica. Além disso, os alcanos possuem cadeia aberta.
Em comparação aos demais hidrocarbonetos, os alcanos destacam-se por sua baixa reatividade, sendo então considerados estáveis. Por conta disso é que historicamente foram chamados de parafinas, uma palavra de origem grega que faz referência à inatividade e à baixa reatividade deles.
Essa baixa reatividade se dá pelo fato de os alcanos só possuírem ligações do tipo sigma (σ) entre os carbonos, diferentemente dos alcenos e alcinos, que já possuem ligação do tipo pi (π) entre os carbonos, a qual é uma ligação covalente mais fraca. Por conta disso, os alcanos não sofrem reação de adição, a qual envolve a quebra da ligação entre os carbonos, mas apenas reação de substituição, em que a ligação desfeita é com o hidrogênio, para que seja feita com outro átomo.
Outro ponto de grande importância dos alcanos é o fato de eles serem apolares e, assim, serem insolúveis em água, um solvente polar. Em relação à água, os alcanos, como os demais hidrocarbonetos, também são menos densos e, em contato com ela, formam uma mistura heterogênea em que se localizam na superfície. É por isso que, em vazamentos de petróleo, vemos a mancha sempre na superfície e nunca afundando.

Como compostos apolares, os alcanos (assim como os demais hidrocarbonetos) realizam as chamadas forças de Van der Waals ou de London (dipolo induzido-dipolo induzido) como interações intermoleculares. Deve-se lembrar que essa é a interação mais fraca que existe, e, por conta disso, espera-se que os alcanos possuam menor ponto de fusão e ebulição se comparados a outros compostos orgânicos de funções diferentes e tamanhos similares.
Contudo, conforme a cadeia carbônica dos alcanos aumenta, maiores serão os pontos de fusão e ebulição, pois, com o aumento do volume molecular, mais bem definida é a interação. Vale lembrar que, conforme a molécula aumenta, mais bem espaçados ficam os polos positivos e negativos gerados no processo e, assim, as forças repulsivas vão diminuindo em relação às forças atrativas.
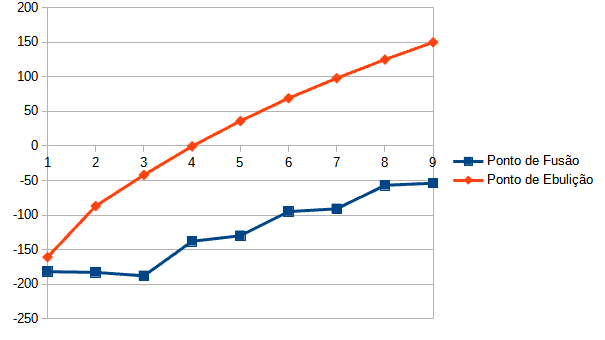
Vale salientar ainda que a presença de ramificações diminui o volume molecular. Sendo assim, quanto mais ramificado for o alcano, menor seu ponto de fusão e ebulição.
Por exemplo, o octano (C8H18), um alcano de cadeia normal, possui ponto de fusão de -56,8 °C e ponto de ebulição de 126 °C, já o 2,2,4-trimetil-pentano (também C8H18), um alcano com três ramificações, possui um ponto de fusão de -107,4 °C e um ponto de ebulição de 99 °C.
Veja também: O que são anidridos orgânicos?
Nomenclatura dos alcanos
Os alcanos seguem, como todos os compostos orgânicos, as regras oficiais da International Union of Pure and Applied Chemistry (Iupac). A última atualização ocorreu no ano de 2013, e as regras estão dispostas no que a Iupac chama de Blue Book (Livro azul).
Seguindo as recomendações, os alcanos devem possuir a estrutura básica de:
- prefixo (que determina o número de carbonos na cadeia principal);
- infixo (que determina a presença de ligações simples, duplas ou triplas na cadeia principal);
- sufixo (que determina a função orgânica da cadeia principal).
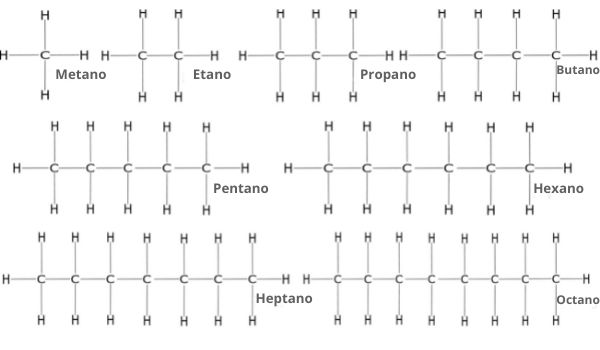
Os alcanos, como hidrocarbonetos, possuem sempre o sufixo -o, e, além disso, como sempre serão uma cadeia saturada (apenas ligações simples entre carbonos), possuem o infixo -an-. A única variação básica será a questão do prefixo, pois temos alcanos de todos os tamanhos possíveis. A tabela a seguir relembra os prefixos de acordo com o número de carbonos na cadeia principal.
|
Prefixo |
Número de carbonos na cadeia principal |
|
Met- |
1 |
|
Et- |
2 |
|
Prop- |
3 |
|
But- |
4 |
|
Pent- |
5 |
|
Hex- |
6 |
|
Hept- |
7 |
|
Oct- |
8 |
|
Non- |
9 |
|
Dec- |
10 |
|
Undec- |
11 |
|
Dodec- |
12 |
|
Eicos- |
20 |
Para alcanos normais (não ramificados), deve-se então juntar o prefixo, o infixo e o sufixo. Por exemplo:
- Para um carbono: prefixo met-, infixo -an- e sufixo -o, sendo, assim, metano.
- Para três carbonos: prefixo prop-, infixo -an- e sufixo -o, sendo, assim, propano.
- Para 12 carbonos: prefixo dodec-, infixo -an- e sufixo -o, sendo, assim, dodecano.
Quando os alcanos possuem ramificações, elas devem ser numeradas antes da cadeia principal. A cadeia principal é a com maior número de carbonos que podemos contar dentro da estrutura a partir de um carbono da extremidade, sendo ramificação toda e qualquer cadeia que não esteja na cadeia principal.
A seguir, temos o exemplo de uma cadeia ramificada, o 3-etil-4-metil-heptano.
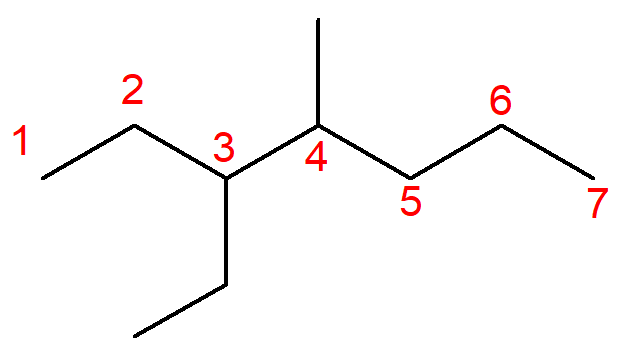
Em vermelho, estão os números dos carbonos da cadeia principal. Perceba que nos carbonos 3 e 4 há cadeias que saem da cadeia principal, sendo consideradas então ramificações. Toda ramificação recebe nome de radical, ou seja, prefixo correspondente ao número de carbonos, mais o sufixo -il, sem a presença de infixos. Nesse caso, a ramificação de dois carbonos chama-se etil, enquanto a de um único carbono se chama metil.
A numeração deve começar do carbono de extremidade mais próxima das ramificações (por isso o sentido da contagem é da esquerda para a direita). No nome oficial, as ramificações devem estar em ordem alfabética, assim, a ramificação etil deve ser nomeada primeiramente. O nome oficial fica como: 3-etil-4-metil-heptano.
Veja também: Nomenclatura de compostos com funções mistas
Fórmula dos alcanos
Como todo hidrocarboneto, os alcanos possuem em sua constituição apenas átomos de carbono e hidrogênio. Nos alcanos em específico, o número de hidrogênios sempre será o dobro do número de carbonos, acrescido de duas unidades. Por isso, definimos a fórmula geral dos alcanos como sendo CnH2n+2, em que n é o número de carbonos.
Exemplo: o metano é o alcano de um único carbono, assim o valor para n é igual a 1. Sendo assim:
H = 2n + 2
H = 2 . (1) + 2
H = 2 + 2
H = 4
Por isso, concluímos que a fórmula molecular do metano é CH4.
Tenha atenção para as cadeias ramificadas, pois as ramificações também contam para a fórmula. No exemplo do tópico anterior, 3-etil-4-metil-heptano, podemos contar, ao todo, 10 carbonos: dois carbonos na ramificação etil, um carbono na ramificação metil e mais sete carbonos na cadeia principal; logo, o valor de n é igual a 10. Assim:
H = 2n + 2
H = 2 . (10) + 2
H = 20 + 2
H = 22
A fórmula molecular do 3-etil-4-metil-heptano é C10H22.
Fontes de obtenção de alcanos
Basicamente, os alcanos são extraídos do petróleo e do gás natural.
Segundo o Serviço Geológico do Brasil (CPRM), a teoria mais aceita sobre a formação do petróleo é a de que ele surgiu da decomposição praticamente anaeróbia de matéria orgânica (principalmente algas) pela ação de bactérias. Com o passar dos anos, essa matéria decomposta foi se sedimentando, e o peso promovido pelas sucessivas camadas levou à compactação e ao aquecimento da matéria, levando às transformações que originaram o petróleo.
O petróleo extraído deve ser levado para uma refinaria em que o devido tratamento lhe é realizado por processos físicos (como a destilação fracionada) e químicos (como o craqueamento e a reforma catalítica) para a obtenção de suas frações de interesse, compostas por hidrocarbonetos, muitos deles alcanos.
O gás natural também se forma no subsolo por meio da decomposição da matéria orgânica, contudo, como o próprio nome diz, é um gás e, por isso, é rico em hidrocarbonetos mais voláteis, como o metano.
Aplicações dos alcanos
Um dos principais usos do carbono é na geração de energia. O metano é o principal gás dos gases encanados que chegam em nossas casas para o aquecimento da água e funcionamento do fogão. O metano, com o etano, também forma a mistura gasosa do gás natural veicular (GNV), uma alternativa mais barata do que a gasolina e o álcool.
Já o gás liquefeito de petróleo (GLP), uma mistura pressurizada dos gases propano e butano, é muito utilizado nos botijões de gás, uma alternativa ao gás encanado ou para regiões em que o serviço não está disponível.
![Funcionário de uma distribuidora de gás realizando entrega de um botijão, contendo o GLP. [1]](https://s3.static.brasilescola.uol.com.br/be/2021/08/botijao-gas.jpg)
Os alcanos também estão presentes na constituição da gasolina e do diesel. O isoctano (C8H18), por exemplo, é considerado o índice 100 da octanagem da gasolina, um índice importante sobre a resistência à detonação do combustível dentro da câmara de combustão do motor. O conhecimento da octanagem faz com que possamos escolher o combustível mais adequado para nosso motor.
Outras utilizações estão:
- na confecção de lubrificantes, querosene;
- na produção de asfalto e solventes para a indústria química.
Apesar da grande variabilidade de utilização, os alcanos, como combustíveis fósseis, estão ligados ao Aquecimento Global Antropogênico, e, por isso, a sua utilização energética desenfreada vem sendo combatida por ambientalistas e militantes da área. Vale salientar que o processo de formação do petróleo e gás natural é lento, e, por isso, são considerados fontes não renováveis de alcanos.
Exercícios resolvidos sobre alcanos
Questão 1 - (Udesc 2011) Analise o composto representado na figura abaixo.
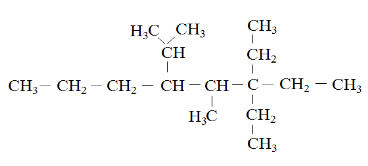
Assinale a alternativa correta em relação ao composto.
A) Este composto representa um alcano de cadeia linear.
B) Este composto possui apenas três carbonos terciários.
C) Este composto possui quatro insaturações.
D) Neste composto encontra-se apenas um carbono assimétrico.
E) Este composto é representando pela forma molecular C16H32.
Resolução
Alternativa B
Como o referido composto só possui carbonos e hidrogênios, então, podemos concluir que é um hidrocarboneto. Além disso, a cadeia é aberta e só existem ligações simples entre os carbonos, e, por isso, podemos concluir que estamos diante de um alcano. Com isso, podemos eliminar as alternativas A (pois a cadeia é ramificada), C (pois não há insaturações) e E (pois C16H32 não obedece à fórmula geral dos alcanos).
Existem dois carbonos assimétricos nessa cadeia (que se ligam a quatro grupos completamente diferentes, chamados também de carbonos quirais), justamente os dois carbonos que estão na forma CH da cadeia principal, o que elimina a alternativa D.
Sendo assim, o gabarito correto é o da alternativa B, pois de fato existem três carbonos terciários (que se ligam a outros três carbonos), que são os três carbonos na forma CH (agora incluindo o que está na ramificação).
Questão 2 - (PUC RJ) Considere as afirmativas a seguir sobre o 2-metilpentano.
I. Possui cadeia carbônica normal.
II. Possui fórmula molecular C6H14
III. É um hidrocarboneto insaturado.
IV. Possui três átomos de carbono primários.
É correto o que se afirma somente em:
A) I e II
B) I e III
C) I e IV
D) II e III
E) II e IV
Resolução
Alternativa E
A estrutura do 2-metilpentano é a que se segue:
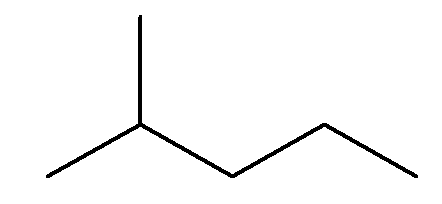
Por ser uma estrutura ramificada, a cadeia não é normal.
Como tem seis carbonos (cinco na principal, mais um na ramificação) e é um alcano, sua fórmula molecular segue a fórmula geral CnH2n+2, sendo então C6H14.
Não possui insaturações, apenas ligações simples; logo, é saturado.
E possui três carbonos primários, que são os três carbonos da extremidade, pois só se ligam a um carbono.
Assim, estão corretas as afirmações II e IV, alternativa E.
Crédito da imagem
[1] Joa Souza / Shutterstock
Por Stéfano Araújo Novais
Professor de Química








