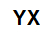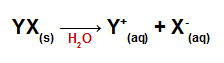O que são sais inorgânicos?
O que são sais inorgânicos? Trata-se de compostos iônicos formados por cátions e ânions que apresentam inúmeras aplicações.

Imprimir
Texto:
A+
A-
Escrito por: Diogo Lopes Dias
Escritor oficial Brasil Escola
De estudante para estudante
Mande sua pergunta
Artigos Relacionados
O que é base?
Clique aqui e conheça as bases, substâncias inorgânicas que apresentam como principal característica a dissociação quando misturadas com água. Tenha acesso a conhecimentos básicos e imprescindíveis como solubilidade, capacidade de dissociação (força) e nomenclatura das bases.
O que é Química?
O que é sal hidratado?
Descubra o que é um sal hidratado e aprenda a utilizar a regra de nomenclatura para essa classe de sais inorgânicos.
O que é Química?
O que é ácido forte?
Clique neste link e conheça todos os critérios utilizados para definir um ácido forte. A classificação pode ser feita a partir da quantidade de íons produzidos por esses compostos quando adicionados à água ou por meio da simples análise da fórmula molecular do ácido.
O que é Química?
O que é óxido?
Acesse este link e passe a saber o que é um óxido, a forma utilizada para identificar esse importante grupo de substâncias inorgânicas, bem como as regras de nomenclatura utilizadas para nomeá-los e as principais classificações (duplo, ácido, básico, anfótero e neutro) que eles podem receber.
O que é Química?
Equações de dissociação de sais inorgânicos
Clique a aprenda como devem ser construídas as equações de dissociação de sais inorgânicos.
Química
Sulfatos
Conheça as substâncias iônicas do grupo dos sulfatos, que inclui, por exemplo, o giz, o gesso e o sal amargo.
Química
Nitratos
Leia sobre os nitratos e descubra suas características e usos. Veja de que forma eles podem agir no nosso corpo e resolva os exercícios propostos sobre o tema.
Química
Cloretos
Aprofunde seus estudos sobre as substâncias iônicas do grupo dos cloretos.
Química
Carbonatos
Conheça a constituição, as fontes e as principais aplicações do grupo dos carbonatos, substâncias inorgânicas muito presentes na Terra.
Química
Funções inorgânicas
Confira a definição das principais funções inorgânicas existentes, bem como exemplos e equações referentes a elas.
Química
Reações de dupla troca
Produtos que caracterizam este tipo de reação.
Química
Sais Minerais
Conheça os principais sais minerais.
Química
Sal Light
Sal Light, composto por cloreto de sódio e cloreto de potássio, paciente com pressão alta, baixo teor de sódio, sódio metálico, sal de cozinha, íons sódio.
Química
Sais no cotidiano
Sais no cotidiano, carbonato de cálcio, cloreto de sódio, fluoreto de sódio, nitrato de potássio, nitrato de sódio, carbonato de sódio, carbonato ácido de sódio, bicarbonato de sódio, sulfito de sódio, salitre-do-chile, soda.
Química
PUBLICIDADE