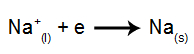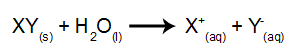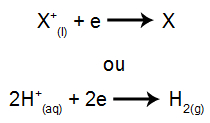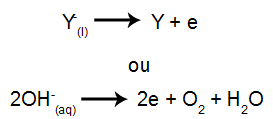O que é eletrólise?
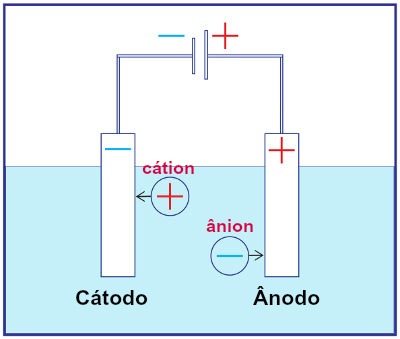
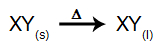
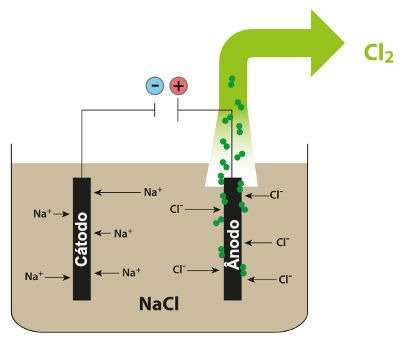
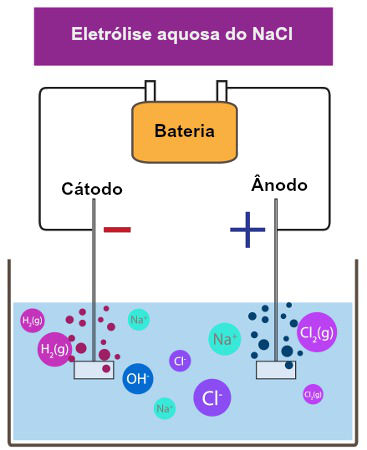
O que é eletrólise? É uma forma de produção de substâncias químicas a partir da reação de oxidação e redução provocadas por uma descarga elétrica.

Imprimir
Texto:
A+
A-
Escrito por: Diogo Lopes Dias
Escritor oficial Brasil Escola
De estudante para estudante
Mande sua pergunta
Videoaulas
Artigos Relacionados
O que é eletrólise ígnea?
Aprenda o que é a eletrólise ígnea e entenda quais são os processos e substâncias que podem ser originadas a partir desse importante fenômeno químico.
O que é Química?
Eletrólise da água
Conheça o processo de eletrólise da água usado para produzir os gases hidrogênio e oxigênio.
Química
Eletrólise Ígnea
Entenda como ocorre a eletrólise, em especial a eletrólise ígnea, um processo muito importante industrialmente, pois produz substâncias que não existem na natureza.
Química
Pilhas e Baterias de Lítio
Conheça o funcionamento das pilhas e baterias de lítio e de íon lítio usadas em marca-passos, telefones celulares e computadores portáteis.
Química
História das pilhas
Conheça a história das pilhas, qual situação desencadeou os estudos relacionados a elas, que cientistas estavam envolvidos e como houve progresso nesse campo.
Química
Eletrólise com Eletrodos Ativos
A eletrólise com eletrodos ativos, isto é, que sofrem reação de oxirredução, é usada principalmente na purificação do cobre e na galvanoplastia.
Química
Pilhas alcalinas
Clique aqui e conheça as diferenças entre as pilhas alcalinas e as pilhas ácidas!
Química
Qual a diferença entre pilhas e baterias?
Veja a definição e exemplos desses circuitos elétricos.
Química
Baterias de níquel-cádmio
Conheça mais sobre as pilhas recarregáveis.
Química
Aplicação da Eletrólise
Aplicações da Eletrólise, galvanoplastia, niquelação, cromação, níquel, cromo, cátodo, sódio, alumínio, cloro, soda cáustica, gás hidrogênio, eletrólise ígnea, eletrólise aquosa, metais alcalinos, alcalino-terrosos, gás cloro.
Química
Função da eletrólise
Entenda a função da eletrólise, processo químico não espontâneo provocado por corrente elétrica.
Química
PUBLICIDADE