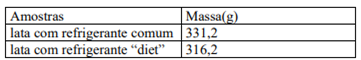
O que é concentração comum?
A concentração comum é uma medida da quantidade de soluto em uma solução, a qual expressa a relação entre a massa do soluto e o volume da solução em gramas por litro (g/L).

Imprimir
Texto:
A+
A-

Escrito por: Jhonilson Pereira Gonçalves
Graduado em ciências licenciatura/química (UEMA), mestre em química (UFMA) e pós-graduado em metodologia do ensino de física e química. Possui experiência na área da educação como professor do ensino fundamental ao superior.
De estudante para estudante
Mande sua pergunta
Artigos Relacionados
O que é Concentração de Soluções Químicas?
A concentração das soluções é muito importante em laboratórios, indústrias, hospitais e em outras ocasiões do dia a dia. Entenda o porquê aqui!
O que é Química?
O que é diluição?
Clique e aprenda o que é, como pode ser realizada e os cálculos envolvidos em uma diluição de soluções.
O que é Química?
O que é molalidade?
Entenda o que é a concentração de soluções denominada molalidade e aprenda quais são as fórmulas utilizadas para realizar os cálculos que a envolvem.
O que é Química?
O que é uma solução química?
Veja a definição de solução química, exemplos e como pode ser realizada a sua classificação.
O que é Química?
Partes por milhão (ppm)
A concentração em partes por milhão (ppm) é feita relacionando-se a massa de soluto presente em 1000000 gramas da solução.
Química
Mistura de soluções com ocorrência de reações químicas
Quando se mistura solução com reação, é necessário saber equacionar as reações e conhecer a proporção em número de mol dos reagentes e dos produtos.
Química
Mistura de soluções de mesmo soluto sem reação química
Clique e conheça as particularidades e os cálculos relacionados com uma mistura de soluções de mesmo soluto sem reação química.
Química
Solubilidade dos sais
Confira um estudo prático e detalhado sobre as questões que envolvem a solubilidade dos sais!
Química
Gráficos das curvas de solubilidade
Aprenda a analisar, interpretar e construir os gráficos de curvas de solubilidade. Saiba também como se relacionam com a classificação de uma solução.
Química
Como as substâncias se dissolvem
Saiba qual fator interfere na solubilidade.
Química
Concentração comum de soluções
Aprenda o que é e como é determinada a concentração comum de uma solução, isto é, a razão entre a massa do soluto e o volume da solução.
Química
Soluções
Saiba quais são as características, os tipos e os cálculos que envolvem soluções, misturas homogêneas compostas por um ou mais solutos.
Química
Coeficiente de solubilidade
Aprenda o que é o coeficiente de solubilidade, qual é a sua relação com as soluções insaturadas, saturadas e supersaturadas e como ele varia com a temperatura.
Química
Soluto e solvente
Entenda a definição de soluto e de solvente, veja exemplos e como o tipo de soluto interfere na solução química que é formada.
Química
PUBLICIDADE






 = massa do soluto em gramas
= massa do soluto em gramas