PUBLICIDADE
A lei de Dalton enuncia que a pressão parcial de cada gás de uma mistura gasosa é igual à pressão que ele exerceria ocupando o volume da mistura, à mesma temperatura. Portanto, a pressão total da mistura gasosa é a soma das pressões parciais de cada gás que a compõe.
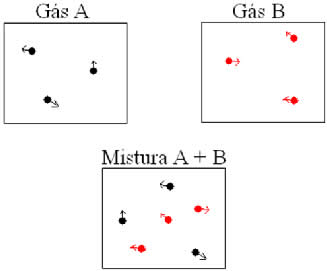
Vamos considerar dois tipos de gases, A e B. Cada um deles ocupa o mesmo volume V, e possui a mesma temperatura T. Se aplicarmos a equação de Clapeyron nos dois gases A e B, temos:
pA .V= nA .R .T e pB .V= nB .R .T
Como mostra a figura acima, se misturarmos os dois gases, o número de mols dos gases da mistura (nm) passa a ser:
nm= nA+ nB
Onde:
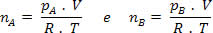
Mas nm = (Pm . V) / R . T; então temos:
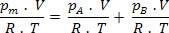
Fazendo algumas simplificações na expressão acima, temos:
pm= pA+ pB (Lei de Dalton)
Podemos aplicar a gases de volumes e temperaturas distintas o mesmo raciocínio. Vejamos a figura abaixo, na qual dois balões interligados por um tubo de volume desprezível possui uma torneira de contato. Esses balões possuem dois gases A e B, com temperaturas e volumes diferentes um do outro. Pela figura vemos que a torneira está fechada, portanto:
pA .V= nA .R .T e pB .V= nB .R .T
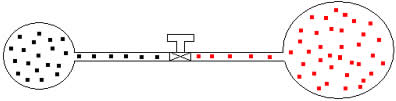
Posteriormente, se abrirmos a torneira, veremos que os gases se misturam, como mostra a ilustração abaixo:
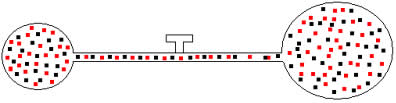
Para essa mistura, temos as seguintes relações:
Vm=VA+ VB
pA .V= nA .R .T
pB .V= nB .R .T
Então, temos que a relação final dessa mistura pode ser estendida a uma mistura de n gases. Assim:
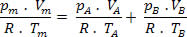
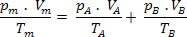
Por Domiciano Marques
Graduado em Física
Equipe Brasil Escola