PUBLICIDADE
O gráfico que representa as fases da matéria termodinamicamente em função da pressão e da temperatura é chamado de diagrama de fases.
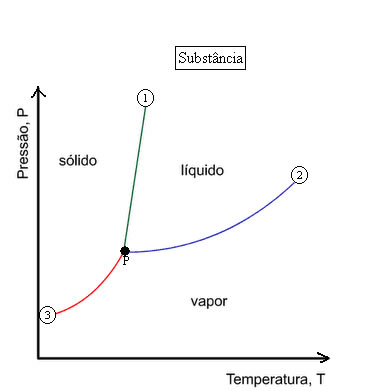
A curva 1, que delimita as regiões das fases sólida e líquida, representa a curva de fusão, onde os estados sólido e líquido da substância estão em equilíbrio.
A curva 2, que delimita as regiões das fases líquido e vapor, representa a curva de vaporização, onde os estados líquido e vapor estão em equilíbrio.
A curva 3, que delimita as regiões das fases sólida e vapor, representa a curva de sublimação, onde os estados sólido e vapor estão em equilíbrio.
O ponto P é um ponto comum às três curvas e é denominado ponto triplo ou ponto tríplice, neste ponto as três fases – sólido, líquido e gasoso, estão em equilíbrio.
O ponto triplo da água ocorre quando a mesma está à temperatura 0,01°C sob pressão de 611,73 pascal.

Água nas três fases, representando o ponto tríplice
Curva de Fusão
A curva de fusão é avaliada sob dois aspectos: para substâncias que se dilatam na fusão (grande parte das substâncias) e para substâncias que se contraem na fusão (água, bismuto, ferro e antimônio).
Grande parte das substâncias: o aumento da pressão é seguido do aumento da temperatura de fusão.
Água – Bismuto – Ferro – Antimônio: o aumento da pressão é seguido de diminuição da temperatura de fusão.
Curva de Vaporização
A vaporização pode ocorrer de duas formas: por ebulição ou por evaporação. A temperatura de vaporização por ebulição depende da pressão de tal forma que à medida que aumentamos a pressão, a temperatura de ebulição também aumenta.
A vaporização por evaporação é um processo que pode ocorrer sob pressão atmosférica, independente da temperatura (moléculas de um líquido, por exemplo, não possuem a mesma velocidade; algumas mais velozes conseguem escapar da superfície do líquido, fazendo com que o mesmo evapore).
Curva de Sublimação
Sólido ou vapor que se encontra abaixo da pressão do ponto triplo, se aquecido ou resfriado respectivamente, passa diretamente de uma fase para outra.
Por Frederico Borges de Almeida
Graduado em Física
Equipe Brasil Escola
Termologia - Física - Brasil Escola





