PUBLICIDADE
A equação de Clapeyron é uma expressão matemática que relaciona grandezas como pressão (P), volume (V), temperatura (T) e o número de partículas (n) que compõem um gás perfeito ou ideal. Essa equação recebe o nome do físico francês Paul Émile Clapeyron e pode ser compreendida como uma generalização das leis empíricas dos gases perfeitos de Gay-Lussac, Charles e Boyle. Ela foi fundamental para o estudo dos gases ideais e possibilitou a evolução das máquinas térmicas, tornando-as cada vez mais eficientes ao longo das últimas décadas.
Veja também: Descobertas da Física que aconteceram por acidente
Tópicos deste artigo
- 1 - Equação de Clapeyron: lei dos gases ideais
- 2 - Fórmula
- 3 - Exercícios resolvidos sobre a equação de Clapeyron
Equação de Clapeyron: lei dos gases ideais
A equação de Clapeyron é derivada de três leis empíricas, isto é, leis que foram determinadas a partir de experimentos. Tais leis explicam o comportamento dos gases em transformações gasosas isovolumétricas (lei de Gay-Lussac), isobáricas (lei de Charles) e isotérmicas (lei de Boyle). De acordo com essas leis:
-
nas transformações isovolumétricas, a razão entre pressão e temperatura termodinâmica de um gás ideal permanece constante;
-
nas transformações isobáricas, a razão entre o volume e a temperatura termodinâmica de um gás ideal é constante;
- nas transformações isotérmicas, o produto da pressão pelo volume de um gás ideal permanece constante.
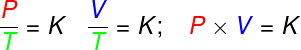
P – pressão (Pa – pascal)
V – volume do gás (m³)
T – temperatura termodinâmica do gás (K – kelvin)
A partir das três leis acima, a equação de Clapeyron determina qual é o valor dessa constante (K) obtida em cada uma das transformações citadas. Segundo a equação de Clapeyron, essa constante é igual ao número de mols multiplicada por uma constante R, conhecida como constante universal dos gases ideais, e igual à constante de Boltzmann multiplicada pelo número de Avogadro.
Fórmula
Confira a seguir a fórmula que é conhecida como equação de Clapeyron:
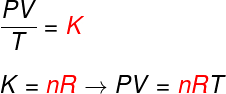
n – número de mols (mol)
R – constante universal dos gases ideais (R = 0,082 atm.l/mol.K ou 8,314 J.mol/K)
Analisando a equação de Clapeyron, é possível perceber que a pressão exercida pelos gases ideais é diretamente proporcional à temperatura e também ao número de mols. Além disso, a pressão é inversamente proporcional ao volume ocupado pelo gás.
O modelo de gás ideal possibilitado pela equação de Clapeyron é largamente utilizado para o desenvolvimento de máquinas movidas por fluidos, como as máquinas movidas a vapor e os motores de combustão interna.
Diversos resultados importantes puderam ser obtidos a partir da equação de Clapeyron. Um deles, por exemplo, prevê que 1 mol de qualquer gás ideal ocupa um volume de 22,4 l quando sujeito à pressão de 1 atm (1,01.105 Pa) e à temperatura de 273 K (0º C).
Veja também: Conceitos mais importantes da Termologia
Exercícios resolvidos sobre a equação de Clapeyron
Questão 1 — (UECE) Um gás que possa ter sua temperatura, seu volume e sua pressão relacionados por PV = nRT apresenta as seguintes características:
a) distância média entre as moléculas muito grande de modo a desprezar as interações intermoleculares, exceto ao colidirem; moléculas sofrem colisões elásticas.
b) distância média entre as moléculas muito pequena; moléculas sofrem colisões inelásticas.
c) distância média entre as moléculas muito grande de modo a desprezar as interações intermoleculares, exceto ao colidirem; moléculas sofrem colisões inelásticas.
d) distância média entre as moléculas muito grande e com fortes interações intermoleculares; moléculas sofrem colisões elásticas.
Resolução:
No modelo de gás ideal, um grande número de partículas sem dimensão move-se em alta velocidade, em direções aleatórias. A única interação sofrida por essas partículas são colisões perfeitamente elásticas, portanto a alternativa correta é a letra A.
Questão 2 — (UFRGS) Considere as afirmações a seguir sobre gases ideais.
I. A constante R presente na equação de estado de gases pV = nRT tem o mesmo valor para todos os gases ideais.
II. Volumes iguais de gases ideais diferentes, à mesma temperatura e pressão, contêm o mesmo número de moléculas.
III. A energia cinética média das moléculas de um gás ideal é diretamente proporcional à temperatura absoluta do gás.
Quais estão corretas?
a) Apenas I
b) Apenas II
c) Apenas III
d) Apenas I e II
e) I, II e III
Gabarito:
Vamos analisar as alternativas:
I. Correta, por isso ela recebe o nome de constante universal dos gases ideais.
II. Correta. De acordo com a equação de Clapeyron, se dois gases ideais apresentam a mesma pressão, temperatura e volume, então o número de partículas desses gases é igual.
III. Correta. De acordo com o teorema de equipartição da energia, a energia cinética das partículas de um gás ideal é proporcional à sua temperatura.
Portanto, a alternativa correta é a letra E.
Questão 3 — (UFJF) Homens como Clapeyron, Boyle, Mariotte, Gay-Lussac, van der Walls, entre outros, desenvolveram importantes estudos envolvendo as propriedades de gases. O comportamento de gases reais aproxima-se de gases ideais em condições de baixas pressões, bem como para gases contidos em um grande volume e gases mantidos a altas temperaturas. Considere que, numa experiência de laboratório, um recipiente de volume V totalmente fechado e contendo 1 mol de um gás ideal sob uma pressão de 4,0 atm é submetido a uma expansão à temperatura constante e igual a 127 º C e que o comportamento desse gás seja o de um gás ideal, conforme mostra o gráfico.
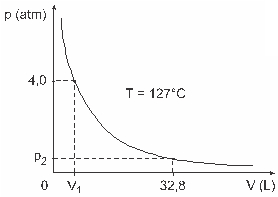
Nesse caso, quando o gás estiver ocupando um volume igual a 32,8 L, a pressão exercida por ele será:
(Dado: a constante universal dos gases perfeitos é R = 0,082 atm.L/mol.K.)
a) 0,32 atm
b) 0,40 atm
c) 1,0 atm
d) 2,0 atm
e) 2,6 atm
Resolução:
Letra C.
Para resolver o exercício, precisamos aplicar os dados na equação de Clapeyron, mas, antes disso, é preciso transformar a temperatura, que está em graus Celsius, para kelvin. Confira:
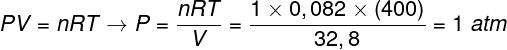
Por Rafael Helerbock
Professor de Física






